"Bitkisel Kozmetik"
DNA'NIN DEĞİŞİM ve DÖNÜŞÜMÜ: IŞIK (FOTON), FREKANS, ELEKTROMANYETİK ALAN (EMF) ve BİTKİSEL BİLEŞENLERİN ETKİSİ
Dr. Aleksi
12/1/202521 min oku
DNA'NIN DEĞİŞİM ve DÖNÜŞÜMÜ:
FOTON, FREKANS, ELEKTROMANYETİK ALAN (EMF) ve BİTKİSEL BİLEŞENLERİN ETKİSİ
DNA (Deoksiribonükleik Asit), biyolojinin ve genetik bilginin temelini oluşturan, hücrelerimizdeki en önemli moleküldür.
1. DNA NEDİR VE MOLEKÜLER YAPISI
DNA, tüm bilinen canlı organizmaların gelişim ve işleyişi için gereken genetik talimatları taşıyan, çift sarmal yapılı büyük bir biyopolimerdir.
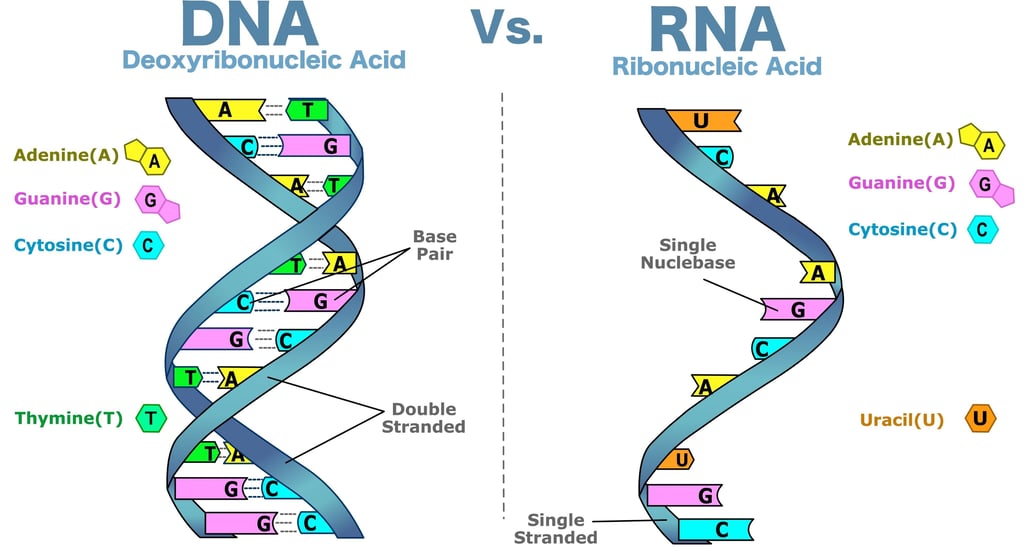
Oluştuğu Moleküller ve Yapı Taşları
DNA'nın yapı taşına Nükleotit adı verilir. Her bir nükleotit, üç temel bileşenden oluşur:
Deoksiriboz Şekeri: Beş karbonlu bir şeker molekülüdür. (RNA'daRiboz şekeri vardır,DNA adını buradan alır.)
Fosfat Grubu: Bir fosfat iyonu (PO _4$) içerir.
Azotlu Bazlar: Dört çeşittir ve genetik bilgiyi kodlayan harfleri temsil eder:
Pürinler: Adenin (A) ve Guanin (G)
Primidinler: Sitozin (C) ve Timin (T)
Moleküler Yapı ve Bağlar
DNA molekülü, iki uzun nükleotit zincirinden oluşur. Bu zincirler, birbirine sarılarak ünlü çift sarmal (double helix) yapısını oluşturur.
Omurga (Zincir İskeleti): Her bir DNA zincirinin omurgası, ardışık deoksiriboz şekerleri ile fosfat gruplarının birbirine bağlanmasıyla oluşur. Bu bağlantı, fosfodiester bağları ile sağlanır. Bu bağlar güçlüdür veDNA zincirine yapısal dayanıklılık sağlar.
Baz Çiftleri (Basamaklar): İki zincir, azotlu bazların birbirine bağlanmasıyla bir arada tutulur ve bu bazlar, sarmalın iç basamaklarını oluşturur. Bazlar her zaman belirli bir kurala göre eşleşir:
Adenin (A) daima Timin (T) ile eşleşir.
Guanin (G) daima Sitozin (C) ile eşleşir.
Hidrojen Bağları: Baz çiftleri, iki zinciri bir arada tutan zayıf Hidrojen Bağları ile bağlanır: A ileT arasında iki, G ileC arasında üç hidrojen bağı bulunur. Bu bağlar zayıf olduğu için, DNA'nın kopyalanma (replikasyon) veya genetik bilgi okuma (transkripsiyon) sırasında kolayca açılmasına olanak tanır.
2. DNA'NIN BİLGİ KÜTÜPHANESİ OLMA AMACI VE İŞLEVSEL FARKLILIK
DNA'nın Amacı ve Temel Fonksiyonu
DNA, hücrenin tüm proteinlerini, enzimlerini ve yapısal bileşenlerini üretmek için gerekli olan talimatlar bütünüdür; yani hücrenin ana bilgi kütüphanesidir.
Görevi: DNA'daki nükleotit dizilimi, genetik kodu (genleri) oluşturur. Bu kod, organizmanın büyümesi, gelişimi, hayatta kalması ve üremesi için gerekli olan protein sentezini yönetir.
Farklı Hücre Tiplerinde DNA Neden Aynıdır?
Temel Kural: İnsan vücudundaki hemen hemen her hücre (sinir, kas, karaciğer hücresi veya deri hücresi), aynı DNA'ya ve aynı genetik bilgi kümesine sahiptir. Bu, organizmanın tek bir döllenmiş yumurtadan geliştiği gerçeğine dayanır.
İşlevsel Farkı Yaratan Nedir? (Gen Ekspresyonu)
Evet, işlevsel farkı yaratan,DNA'nın kendisi değil, genlerin hangi hücrede, ne zaman ve ne ölçüde aktif (açık) veya pasif (kapalı) olduğudur. Bu duruma Gen Ekspresyonu denir ve farkı yaratan mekanizma budur:
Hücre İhtisası: Bir karaciğer hücresi, karaciğer için gerekli olan proteinleri (örneğinalbumin üretimi) kodlayan genleri aktif tutarken, bir sinir hücresi için gerekli olan genleri pasif (susturulmuş) tutar. Aynı şekilde, bir sinir hücresi denörotransmitter üretim genlerini aktif tutar.
Epigenetik Düzenleme: DNA üzerindeki bu aktivite/pasivite durumu, DNA'nın kimyasal yapısının ve onu saran proteinlerin (histonların) modifiye edilmesiyle sağlanır. Bu mekanizmaya Epigenetik denir.
Metilasyon: DNA'ya metil grupları eklenerek genler susturulur.
Histon Değişiklikleri: DNA'nın sarıldığı histon proteinlerinin gevşetilmesi veya sıkılaştırılması, genin okunurluğunu doğrudan etkiler.
Bu sayede, vücuttaki her hücre aynı bilgi kütüphanesine sahip olmasına rağmen, sadece ihtiyacı olan kitapları açar ve böylece o hücreye özgü işlev ve morfolojik farklılık ortaya çıkar
Yaşlanma biyolojisinin ve gençleştirici (rejeneratif) tıbbın en zorlu hedefini, yani kanserleşme riski olmadan sürekli yenilenme (ölümsüzlük) durumunu hedefler. Bu amaca ulaşmak için, telomer uzamasını, DNA onarımını ve hücresel temizliği (Otofaji) senkronize eden, çok yönlü bir strateji kurgulamalıyız.
İşte bu kompleks hedefe ulaşmayı en çok mümkün kılan mekanizmalar ve fitoterapötik bileşenler:
DNA: FİZİKSEL ALANLAR VE BİYOLOJİK BİLGİ ARASINDAKİ KÖPRÜ
1. DNA'NIN FİZİKSEL ENERJİYE DUYARLILIĞI
DNA'nın enerjiye duyarlılığı, moleküler düzeydeki karmaşık yapısından ve kuantum mekaniksel özelliklerinden kaynaklanır.
A. Foton (Işık) Duyarlılığı
Fotonlar,DNA ile üç temel yolla etkileşime girer:
1. Doğrudan Absorpsiyon ve Hasar Oluşumu (UV Işık)
Bu, DNA'nın fotonlarla en çok bilinen, yıkıcı etkileşim şeklidir.
Mekanizma: Yüksek enerjili kısa dalga boylu fotonlar (Ultraviyole - UV ışık), DNA bazları tarafından güçlü bir şekilde doğrudan emilir. Bu enerji, komşu Timin ve Sitozin bazları arasında anormal kovalent bağlar (pirimidin dimerleri) oluşmasına neden olur.
Etkisi: Bu kovalent bağlar, DNA sarmalının normal yapısını bozar, kopyalama hatalarına (mutasyon) yol açar ve hücrenin hayatta kalmasını tehdit eder.
2. Enerji Çekimi ve Enzimatik Onarım (Mavi Işık)
Epigenetik Düzenleme: Görünür ışık ve yakın kızılötesi fotonlar doğrudan DNA'ya hasar vermez. Ancak Kriptokromlar gibi bazı proteinler, ışık fotonlarını algılar ve bu sinyali hücre içine ileterek sirkadiyen ritimleri ve dolaylı olarak gen ekspresyonunu düzenler.DNA molekülü, aldığı hasarı gidermek için foton enerjisini verimli bir şekilde kullanabilir.
Mekanizma: Hücreler, UV ışığının neden olduğu pirimidin dimerleri gibi hasarları onarmak için Fotoliyaz adı verilen özel bir enzime sahiptir. Bu enzim, hasarlı bölgeye bağlanır ve mavi ışıktan (yaklaşık 300-500 nm dalga boyları) foton enerjisini çeker (absorbe eder).
Etkisi: Çekilen bu foton enerjisi, enzimin hasarlı DNA bazları arasındaki anormal kovalent bağı keserek, DNA sarmalını orijinal, doğru formuna geri döndürmesini sağlar. Bu süreç, DNA'nın fotonları tamir amaçlı kullandığının en açık kanıtıdır.
3. Biyofotonik Radyasyon ve Tutarlı İletişim (Ultra Zayıf Işık)
Bu mekanizma, DNA'nın pasif bir alıcı olmaktan çıkıp aktif bir yayıcı olduğunu gösterir.
Mekanizma: Hücresel metabolizma, özellikle oksidatif süreçler ve DNA onarımı sırasında, hücreler Biyofoton adı verilen ultra zayıf ışık yayar. Akademik çalışmalar, DNA'daki fotonların Bose-Einstein Yoğunlaşması adı verilen bir durumda depolandığını ve buradan yayıldığını öne sürmektedir.
Etkisi: Bu ışık, DNA'nın çevresel ve hücresel durumunu yansıtan bir sinyaldir. Bu biyofotonların, hücreler ve organeller arasında tutarlı (rezonanslı) elektromanyetik sinyalizasyon aracı olarak kullanıldığı ve epigenetik düzenlemeleri dolaylı olarak etkilediği düşünülmektedir. Bu, DNA'nın yalnızca bilgi deposu değil, aynı zamanda hücresel iletişimin temel kaynağı olduğunu gösterir.
Yaşam Bir Işık Olgusudur: Hücreler Arası Kuantum İletişimi (Biyofotonlar)
Modern bilim, uzun süre hücreler arasındaki iletişimin sadece kimyasal sinyaller (hormonlar, nörotransmitterler) ve sinir sistemi aracılığıyla gerçekleştiğine inandı. Ancak bu makale, yaşamın temelinde, hücrelerin birbirleriyle ve organellerle iletişim kurduğu enerji ve bilgi aktarımının elektromanyetik süreçleri olduğunu öne sürmektedir. Bu sürecin temel taşı, "yaşam ışığı" anlamına gelen Biyofotonlar'dır.
. Biyofiziksel Gerçeklik: Hücreler Enerjiden Oluşur
Makalenin temel tezi, bilimsel bilgiyi en alt nano düzeye indirdiğimizde ortaya çıkar:
Her Şey Elektromanyetik Alan: Nanometre ölçeğinde, atomlar ve moleküller geleneksel anlamda katı madde değil, organize bir elektromanyetik enerji biçimidir. Hücrelerdeki tüm kimyasal reaksiyonların ve moleküller arası etkileşimlerin temelinde kuantum doğası ve elektromanyetik etkileşimler yatar.
Nano Dünyada Atomlar: Ölçek küçüldükçe, atom çekirdeği bile ışık hızında hareket eden manyetik dalgalardan (protonlar ve nötronlar) oluşan bir elektromanyetik süreç olarak tanımlanır.
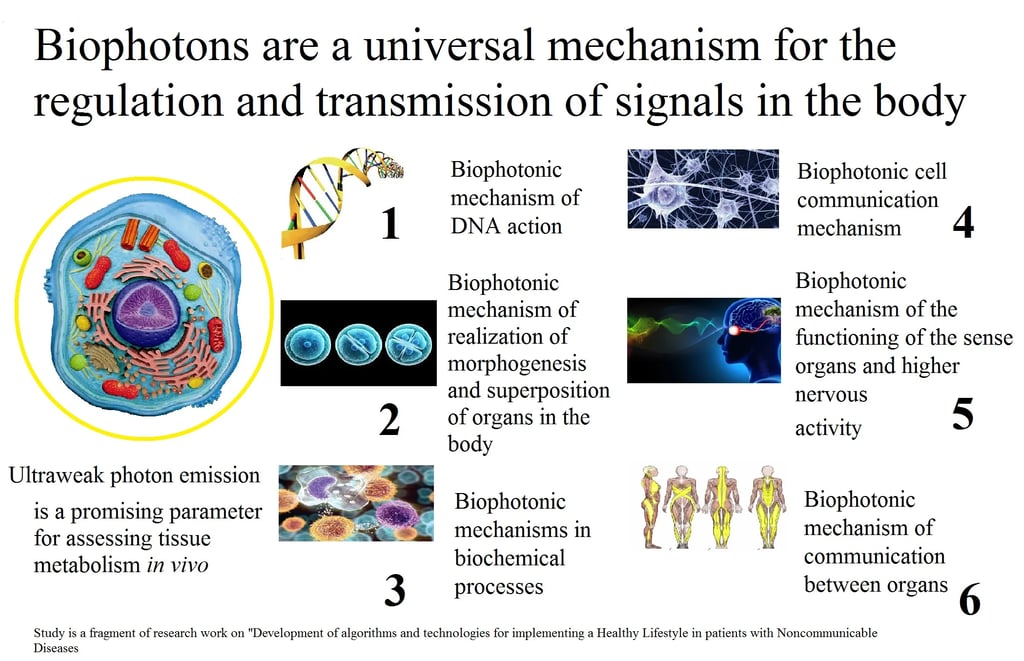
. Biyofotonlar: Ultra Zayıf Işık (UPE) ve Sinyalleme
Tüm canlı hücreler, sürekli olarak ışık yayar. Bu olguya Ultra Zayıf Foton Emisyonu ($\text{UPE}$) veya Biyofoton Emisyonu denir.
Evrensel Optik Olay: UPE}$ (200 ila 800 nm spektral aralığında), insan gözüyle görülemeyen (ultra zayıf) ancak her canlı hücre için evrensel olan bilimsel bir gerçektir.
Amaç ve Tutarlılık: Biyofotonlar sadece metabolizmanın bir yan ürünü değil, aynı zamanda temel bir düzenleyici mekanizmadır. Biyofotonların sahip olduğu tutarlılık (aynı frekans ve fazda hareket etme), hücrelerin bu enerjiyi bir iletişim aracı olarak kullanmasını sağlar. Bu, tek bir hücrenin karmaşık bir organizmadaki diğer tüm hücrelerle iletişim kurmasını sağlayan sinyalleşme mekanizmasıdır.
. DNA'nın Işık Deposu Rolü
DNA'nın pasif bir kitaplıktan ziyade aktif bir ışık deposu olmasıdır:
DNA'dan Yayılan Işık: Hücredeki biyofoton aktivitesinin en az %75'i DNA'dan gelir. DNA, hücre içindeki besinlerden fotonlar şeklinde enerji alan ve biyolojik bir lazer gibi işlev gören sarmal bir genetik materyaldir.
Bose-Einstein Yoğunlaşması: DNA'daki fotonlar, Bose-Einstein Yoğunlaşması (Maddenin 5. Hali) adı verilen bir durumda depolanır. Bu, fotonların "kriyotrap"ta yakalanıp zaman içinde "dondurulduğu" bir fiziksel olaydır. Bu depolanan ışık, DNA molekülünün temel kararlılığını oluşturur.
Önemli Çıkarım: "Çöp" DNA olarak bilinen genetik materyalin neredeyse %98'inin, biyofoton mekanizması aracılığıyla hücre içinde karmaşık elektromanyetik süreçlerin gerçekleştirilmesinden sorumlu olduğu varsayılmaktadır.
. Biyofotonların Rejenerasyon ve Hastalıktaki Rolü
Biyofotonik aktivite, hücrelerin hayati süreçlerini ve sağlığını yansıtır:
Hücresel Yenilenme ve Morfogenez: UPE, hücreler arası rezonanslı sinyalleşmeyi, hücresel aktiviteyi ve hücre yenilenmesi süreçlerini sağlar. Ayrıca, dokuların büyümesini ve şekillenmesini kontrol eden morfogenetik alanın oluşumunda rol oynar.
Hastalık Göstergesi: Sağlıklı doku ve organizmalar, hasarlı ve hastalıklı olanlara kıyasla daha güçlü ve daha kararlı UPE radyasyonuna sahiptir. Hastalıklar ve yaşlanma sırasında, hücrelerin foton enerjisi biriktirme yeteneği azalır. Kanser hücrelerinde ve yaşlanma sırasında bu değişim objektif olarak gözlemlenebilir.
Bağ Dokusu İletimi: Biyofotonlar, organ içindeki hücreler arasında fiber optik prensibine göre (kolajen liflerinden oluşan) bağ dokusu aracılığıyla iletilen bir bilgi alanı oluşturur.
Bu çalışma, yaşamın temelini oluşturan süreçlerin, geleneksel elektro-kimyasal metabolizma kavramından, manyetoelektrokimyasal ve kuantum etkileşim paradigmasına kaydığını gösteriyor. Biyofotonlar, vücuttaki enerji ve bilgi akışını düzenleyen evrensel bir mekanizma ve potansiyel bir klinik değerlendirme aracıdır.
Çöp DNA" Efsanesinin Sonu: Karanlık Maddenin Gizemli Görevi
1. MİT: Hayatın Sırrı ve Gen Sayısı Şaşkınlığı
İnsan Genomu Projesi'nin 2000'li yılların başında tamamlanması, bilim dünyasında büyük bir zafer olarak kutlandı. Bilim insanları, organizmanın karmaşıklığını gen sayısıyla ilişkilendirerek insanın 30 bin ila 100 bin arasında gene sahip olmasını bekliyordu. Ancak, dizileme çalışmaları sonucunda insan genomunun sadece yaklaşık 20 bin protein kodlayan gen içerdiği anlaşıldı. Bu sonuç şaşırtıcıydı; çünkü insandan daha az karmaşık görünen birçok organizma (örneğin yuvarlak solucan C. elegans), aynı sayıda veya orantılı olarak daha fazla gene sahipti. Bu, insan organizmasının karmaşıklığının doğrudan gen sayısıyla ilgili olmadığını gösterdi.
2. Gerçek: Genomun %98'i "Kodlamayan DNA
Genom dizisinin tümü incelendiğinde, şaşırtıcı bir gerçek ortaya çıktı: İnsan DNA'sının yalnızca çok küçük bir kısmı (%2) protein kodlayan genlerden oluşuyordu. Geriye kalan büyük kısma (%98) başlangıçta "Çöp DNA" (Junk DNA) adı verildi.
Bu "çöp"ün, canlılar tarihinde ilkel hücrelere yerleşen ve çoğalan yabancı DNA unsurlarından kaynaklandığı düşünülüyordu.
3. Paradigma Değişimi: İşlevi Olan Karanlık Madde
Modern araştırmalar, bu büyük orandaki atıl dizilerin aslında etkisiz ve işlevsiz olmadığını ortaya koydu. Artık bilim dünyasında bu kısma giderek daha sık "Kodlamayan $\text{DNA}$" (Noncoding $\text{DNA}$) adı verilmektedir.
Kodlamayan DNA'nın Kritik Fonksiyonları:
Karmaşıklığın Anahtarı: Organizmanın karmaşıklığının, protein kodlayan gen sayısından ziyade, kodlamayan DNA miktarıyla bağıntılı olduğu görüşü ağırlık kazanmıştır. Daha karmaşık organizmaların (insan) daha fazla kodlamayan DNA'ya sahip olduğu görülmektedir.
Hastalık Düzenleyicisi: Kodlamayan DNA, doğrudan protein kodlamasa da, protein kodlayan genleri etkileyerek hücre içi süreçler ve birçok kalıtsal hastalığın (Friedreich ataksisi, Charcot-Marie-Tooth) ortaya çıkışında rol oynar.
Telomerler ve Yaşlanma: Kromozom uçlarını oluşturan ve yaşlanmayla yakından ilişkili olan telomerler (TTAGGG tekrar dizisi), özünde bu kodlamayan DNA'dan oluşur ve DNA'nın bütünlüğünü koruma görevi üstlenir.
Koruma Teorisi: "Yalıtım teorisi", kodlamayan bu bölgelerin, hayati genleri kromozom boyunca dağıtarak (intronlar gibi ara parçalarla) çevreden gelen saldırıların (radyasyon) etkisini azalttığını öne sürmüştür.
Sonuç: Kodlamayan DNA'nın büyük kısmı, atıl bir mezarlıktan ziyade, genomun düzenlenmesinde kritik rol oynayan, işlevsel ve hâlâ sırrı çözülmemiş bir "karanlık madde" olduğu anlaşılmıştır. Bilim, bu DNA'nın beklenmedik etkilerine hazır olmalıdır.
B. Frekans ve Elektromanyetik Alan (EMF) Duyarlılığı
DNA molekülü, uzun, sarmal yapısı, fosfat omurgasındaki negatif yük yoğunluğu ve hidrojen bağları nedeniyle bir rezonatör (yankılayıcı) veya anten gibi davranabilir.
Rezonans ve Titreşim: DNA'nın kimyasal bağları ve molekül içindeki su molekülleri, belirli terahertz vegigahertz frekanslarında titreşir. DNA'nın kendi doğal frekansıyla eşleşen dış frekanslar (rezonans), DNA'nın sarmal dinamiklerini ve stabilizasyonunu teorik olarak etkileyebilir.
İyon Kanalları: Düşük frekanslı EMF'ler, hücre zarındaki iyon kanallarını etkileyerek (özellikle Kalsiyum akışını değiştirerek) hücresel sinyalizasyonu tetikler. Bu sinyalizasyon, dolaylı olarak gen ekspresyonunu etkileyen transkripsiyon faktörlerinin aktivasyonuna yol açar.
2. GEN EKSPRESYONU VE EPİGENETİK DÖNÜŞÜM
Frekans ve foton enerjisi,DNA'nın kendisini değil, DNA'nın okunma biçimini değiştirerek gen aktivitesini etkiler. Bu, Epigenetik düzlemde gerçekleşir.
A.DNA'daki Enerji Etkisinin Mekanizması
Enerji alanları, genlerin aktif (açık) veya pasif (kapalı) kalmasını belirleyen histon proteinlerini ve metilasyon desenlerini etkileyebilir:
Histon Değişiklikleri:DNA, Histon adı verilen proteinlerin etrafına sarılarak Kromatin yapısını oluşturur.EMF veya stres sinyalleri, Histon asetilasyonu veya metilasyonunu değiştiren enzimleri (Histon Asetil Transferazlar -HAT'lar) etkileyebilir.
Sonuç: Kromatin yapısı gevşerse (ökaromatin), genler aktif hale gelir ve protein sentezi artar. Yapı sıkılaşırsa (heterokromatin), genler pasif hale gelir.
DNA Metilasyonu: Enerji alanları, DNA metilasyon enzimlerinin (DNMT'ler) aktivitesini değiştirerek gen promoter bölgelerine metil grupları eklenmesini veya çıkarılmasını etkileyebilir.
Sonuç: Promoter bölgesindeki yüksek metilasyon, ilgili geni susturur (pasif gen).
B. Dönüşüm Potansiyeli
DNA'nın kendisi, mutasyonlar haricinde (yüksek enerjili iyonlaştırıcı radyasyon veyaUV gibi) fiziksel bir alandan doğrudan ve kalıcı olarak genetik kodunu değiştirmez. Ancak, Epigenetik Dönüşüm mümkündür:
Kalıcı Etki: Çevresel enerjiden gelen sürekli sinyaller, kalıcı epigenetik izler bırakabilir. Bu, bir genin aktif veya pasif olma durumunu uzun vadede belirler.
Örnek: Kronik düşük seviyeliEMF'lere maruz kalmak, stres yanıtı genlerini kalıcı olarak daha duyarlı (aktif) hale getirerek organizmanın fizyolojik tepkilerini değiştirebilir.
DNA: FİZİKSEL ALANLAR VE EPİGENETİK KOD ARASINDAKİ KUANTUM REZONATÖR
1. DNA'NIN KUANTUM BİYOLOJİK TEMELLERİ VE ENERJİYE DUYARLILIĞI
DNA, sadece genetik bilgiyi depolayan bir molekül değil, aynı zamanda çevresel enerji sinyallerini algılayan ve buna tepki veren, yüksek derecede düzenlenmiş bir kuantum yapısıdır. DNA'nın bu enerjiye duyarlılığı, molekülün fiziksel geometrisinden ve atom altı düzeydeki etkileşimlerinden kaynaklanır.
A. Foton (Işık) Etkileşimi
Fotonlar, DNA ile hem hasar verici hem de onarıcı yollarla etkileşime girer:
UV Hasarı ve Onarımı: Ultraviyole (UV) fotonları, DNA bazları tarafından emilerek pirimidin dimerleri oluşmasına ve mutasyonlara yol açar. Ancak hücre, bu hasarı algılamak ve onarmak için Fotoliyaz gibi enzimleri kullanır; bu enzimler, hasarı onarmak için mavi ışıktan foton enerjisi çeker. Bu, DNA'nın çevreden foton enerjisini verimli bir şekilde kullandığının en açık kanıtıdır.
Biyofotonik DNA Onarımı ve Hücresel İletişim: Hücrelerden yayılan ultra zayıf ışık olan Biyofotonlar, DNA onarımı ve hücreler arası iletişimle ilişkilidir. DNA'nın onarım sürecindeki hasar düzeyi, yayılan Biyofotonların spektral analizi ile dolaylı olarak ölçülebilir. Bu fotonların, hasarlı hücreler ile komşu hücreler arasında epigenetik sinyalizasyonu tetiklediği hipotezi ileri sürülmektedir.
B. Frekans ve Elektromanyetik Alan (EMF) Duyarlılığı
DNA sarmalı, fosfat omurgasındaki negatif yük yoğunluğu ve hidrojen bağları ağı nedeniyle bir anten veya rezonatör (yankılayıcı) gibi davranabilir.
Rezonans ve Fonon Etkileşimi: DNA'nın kimyasal bağları, terahertz ve gigahertz frekanslarında titreşir. Bu frekanslara dışarıdan gelen uygun EMF frekansları (Fononlar), DNA'nın titreşim modlarına rezonans yoluyla enerji aktarabilir. Bu enerji aktarımı, DNA'nın sarmal dinamiklerini ve genetik bilgi aktarım hızını etkileyebilir.
İyon Kanal Modülasyonu: Düşük frekanslı EMF'ler, doğrudan DNA'yı değil, hücre zarındaki iyon kanallarını (özellikle Kalsiyum akışını) etkiler. Bu iyon akışı, hücresel sinyalizasyonu başlatarak, sonuçta gen ekspresyonunu etkileyen transkripsiyon faktörlerini aktive eder.
2. GEN EKSPRESYONU, AKTİF/PASİF GENLER VE EPİGENETİK DÖNÜŞÜM
Frekans ve foton enerjisi, DNA'nın kendisini değil, genlerin aktif (okunabilir) veya pasif (susturulmuş) kalmasını belirleyen Epigenetik yapıları etkiler. Bu, DNA'nın okunma biçiminde dönüşüme yol açar.
A. Aktif/Pasif Genler Üzerindeki Etki Mekanizması
Enerji alanları, DNA'nın histon proteinleri etrafına sarıldığı Kromatin yapısını modüle eder:
Histon Değişiklikleri: EMF veya çevresel stres sinyalleri, Histon asetilasyonu veya metilasyonunu düzenleyen enzimleri (HAT'lar) etkileyebilir. Kromatin yapısının gevşemesi (O¨karomatin), genleri aktif hale getirir ve protein sentezini artırır. Sıkılaşma (Heterokromatin) ise genleri pasif hale getirir (susturur).
DNA Metilasyonu: Enerji alanları, DNA metilasyon enzimlerinin (DNMT'ler) aktivitesini değiştirerek gen promoter bölgelerine metil gruplarının eklenmesini veya çıkarılmasını etkileyebilir. Promoter bölgesindeki yüksek metilasyon, ilgili geni uzun vadede susturur.
B. DNA'nın Değişim ve Dönüşüm Potansiyeli
DNA'nın kendisi, mutajenik radyasyon dışında fiziksel bir alandan doğrudan ve kalıcı olarak genetik kodunu değiştirmez. Ancak, Epigenetik Dönüşüm mümkündür:
Çevresel enerjiden gelen sürekli sinyaller, kalıcı epigenetik izler bırakabilir. Bu, bir genin aktif veya pasif olma durumunu uzun vadede belirler. Bu, organizmanın stres yanıtı genlerini kalıcı olarak daha duyarlı (aktif) hale getirerek fizyolojik tepkilerini değiştirebilir.
Bu epigenetik değişimler, genetik kodun kendisi (A,T,C,G dizilimi) değişmeden, fenotipi ve hücresel davranışı köklü biçimde dönüştürebilir.
1. TERT (TELOMERAZ) VE MİTOKONDRİYAL FONKSİYONUN EMF DUYARLILIĞI
Telomerazın katalitik alt birimi olan TERT (Telomerase Reverse Transcriptase), sadece telomerleri uzatmakla kalmaz; aynı zamanda hücreyi stres ve hasara karşı korumak için çekirdekten ayrılarak mitokondriye transloke olur. Bu işlevi, DNA'nın çevresel enerji alanlarına verdiği tepkilerle doğrudan ilişkilidir.
A. TERT Translokasyonu ve Oksidatif Stres Yanıtı
Mekanizma: Hücreler oksidatif stres veya düşük enerji (ATP) seviyeleri altında kaldığında, TERT çekirdekten ayrılarak mitokondrinin içine taşınır. Burada, Mitokondriyal DNA'yı (mtDNA) reaktif oksijen türlerinin (ROS) zararlı etkilerinden korur ve hücrenin apoptoz (programlanmış hücre ölümü) sinyallerini baskılar.
EMF Duyarlılığı:EMF'lere maruz kalmak, hücre içi ROS üretimini ve kalsiyum akışını etkilediği için, TERT'in bu koruyucu translokasyon mekanizmasını da etkileme potansiyeli vardır. EMF'ler, TERT'in mitokondriyal DNA korunumu üzerindeki etkisini artırarak veya azaltarak hücrenin stres yanıtını manipüle edebilir.
Analiz Ekseni: Düşük frekanslı EMF uygulamalarının, TERT'in mitokondriye taşınma hızını ve ROS üzerindeki etkisini nasıl değiştirdiği belirlenmelidir. Bu, TERT'in nöroprotektif potansiyelini optimize etmek için kritik bir adımdır.
2. EPİGENETİK MODÜLASYON İÇİN DÜŞÜK FREKANSLI EMF'LERİN TERAPÖTİK KULLANIMI
DNA'nın frekanslara duyarlılığı, genlerin aktivasyon/pasivasyon durumunu değiştiren epigenetik mekanizmalar üzerinden terapötik potansiyel sunar.
A. Susturulmuş Genleri Hedefleme
Mekanizma: Kronik hastalıklar (örneğinkanser) genellikle tümör baskılayıcı genlerin yüksek DNA Metilasyonu nedeniyle susturulmasıyla ilerler. Düşük frekanslı, atımlı EMF'lerin (Pulsed EMF -PEMF) belirli frekansları, DNA metilasyonunu ve Histon Asetilasyonunu düzenleyen enzimleri etkileyebilir.
Terapötik Hedef: Histon Asetil Transferazlar (HAT'lar), kromatin yapısını gevşeterek genleri açar. PEMF'lerin HAT aktivitesini artırarak, kanserle savaşan genlerin yeniden ifade edilmesini sağlayabileceği düşünülmektedir. Bu, PEMF'lerin, susturulmuş genleri yeniden aktive ederek hastalığın seyrini değiştirebilecekleri anlamına gelir.
Analiz Ekseni: Düşük enerjiliEMF'lerin, özellikle Schumann Rezonansları gibi doğal frekansların, Histon düzenleyici enzimlerin aktivitesini ve hedef genlerin ekspresyonunu (mRNA seviyesini ) nasıl değiştirdiğini gösteren kontrollü in vitro ve in vivo çalışmalar yapılmalıdır.
3. DNA'NIN KUANTUM KOHERANSI VE FONON ETKİLEŞİMİ
DNA'nın kuantum düzeyindeki dinamikleri ve çevresel titreşimlerle etkileşimi, genetik bilginin bütünlüğü ve işlenme hızına dair yeni kapılar açmaktadır.
A. Kuantum Koheransı ve Bilgi Bütünlüğü
Kuantum Koheransı: DNA sarmalındaki hidrojen bağlarında yer alan protonlar ve elektronlar, bir kuantum durumu içinde kalabilirler (Koherans). Bu durum, genetik bilginin hassasiyetle ve hatasız bir şekilde iletilmesi için kritik olabilir. DNA'nın sarmal dinamikleri, bir tür Kuantum Biyolojik Hesaplama olarak işlev görebilir.
Fonon Etkileşimi: Fononlar, kristal yapılar içindeki titreşim enerjisi paketleridir ve DNA'nın çevresinden enerji almasının bir yoludur. Dış frekanslardan gelen Fononlar, DNA'nın titreşim modlarıyla rezonansa girerek enerji transferi yapabilir. Bu rezonans, DNA'nın sarmal dinamiklerini değiştirerek, bilgi okuma hızını ve onarım mekanizmalarının etkinliğini etkileyebilir.
Analiz Ekseni: DNA sarmalındakiFonon yol açıcı titreşim modlarının belirlenmesi ve dış EMF kaynaklarıyla bu modların hedeflenmesinin, DNA polimerazın (kopyalayıcı enzim) hata oranını nasıl değiştirdiğini kuantum mekaniksel ve spektroskopik yöntemlerle incelemek.
4. BİYOFOTONİK DNA ONARIMI VE HÜCRELER ARASI İLETİŞİM
DNA onarımı ve hücre metabolizması sırasında hücrelerden yayılan ultra zayıf ışık olanBiyofotonlar, hücresel iletişim ve enerji durumunun bir göstergesidir.
A. Biyofoton Spektrumu ve Hücresel Enerji
Biyofotonların Kaynağı: Biyofotonlar, esas olarak ROS'un serbestleştiği anlar gibi oksidatif süreçlerden ve DNA onarım döngülerinden kaynaklanır. DNA'nın hasar görme derecesi ve hücresel stres seviyesi, yayılanBiyofotonların şiddetini vespektral dağılımını doğrudan etkiler.
Hücreler Arası İletişim: Biyofotonların, hasarlı hücreler ile komşu sağlıklı hücreler arasında epigenetik sinyalizasyonu tetiklediği ve bu şekilde kolektif bir hücresel yanıtı düzenlediği hipotezi üzerinde durulmaktadır. Bu, DNA'nıngenetik kodu fiziksel olarak aktarmak yerine, bir ışık sinyali ile çevresel stres bilgisini aktardığı anlamına gelebilir.
Analiz Ekseni: vDNA hasarı altındaki hücrelerin yayılanBiyofoton spektrumunun yüksek çözünürlükle ölçülmesi ve bu spektrumdaki değişimlerin, komşu hücrelerdeki spesifik genlerin (örneğin sitokinler veya anti-apoptotik genler) epigenetik durumunu(metilasyon seviyesini ) nasıl değiştirdiğini belirlemek.
Bu dört analiz ekseni, DNA'nın enerjiye duyarlı bir kuantum arayüzü olarak anlaşılmasına ve EMF'lerin nöroproteksiyon, yaşlanma ve kanser terapisindeki potansiyel kullanım yollarının belirlenmesine olanak sağlayacaktır.
DNA'nın ve hücresel mekanizmaların ışığa (fotonlara) duyarlılığı, Fotobiyomodülasyon (PBM) tedavisinin temelini oluşturur. Kanserleşme riski olmadan DNA onarımı, hücresel yenilenme ve gençleşme etkisi yaratmak için genellikle düşük güçlü, belirli dalga boylarındaki kırmızı ve yakın kızılötesi (NIR) ışıklar kullanılır. Bu konuda bilimsel olarak en çok önerilen ve kanıtlanan dalga boylarını, etkilerini ve mekanizmalarını senin için detaylandırıyorum.
FOTOBİYOMODÜLASYON (PBM):
DNA VE HÜCRESEL GENÇLEŞME İÇİN IŞIK SPEKTRUMU:
Hücresel yenilenmeyi ve gençleşmeyi hedeflerken, DNA'ya hasar veren yüksek enerjili (UV) ışıklardan kaçınılmalı; bunun yerine, hücre metabolizmasını uyaran düşük enerjili fotonlar tercih edilmelidir.
1. SAĞLIK İÇİN EN UYGUN IŞIN VE RENK SPEKTRUMU:
DNA onarımı ve gençleşme üzerinde doğrudan ve dolaylı olumlu etkiye sahip olduğu gösterilen ana dalga boyları (renkler) şunlardır:
Kırmızı Işık 630 - 670 nm Mitokondriyal Uyarı: Sitokrom c Oksidaz (CCO) enzimini uyararak ATP üretimini artırır. Hücresel Enerjinin Artması (Gençleşme etkisi).
Yakın Kızılötesi (NIR) 810 - 850 nm. Doku Derinliğine Penetrasyon: Derin doku ve kemik iliğine ulaşarak kök hücre aktivasyonunu ve dolaşımı artırır. DNA Onarımının Hızlanması (Dolaylı).
Mavi Işık 450 - 490 nm Dolaylı DNA Onarımı: UV hasarını onaran Fotoliyaz enzimini aktive etmek için kullanılır. DNA Hasarını Giderme (Mutasyon Önleme).
A. Kırmızı ve NIR Işığın Önemi (Mitokondriyel Odak) PBM'nin gençleşme ve onarım üzerindeki gücü, DNA'nın bulunduğu çekirdeği doğrudan hedeflemekten ziyade, hücrenin enerji santrali olan Mitokondriyi hedeflemesinden gelir.
ATP Artışı: Kırmızı ve NIR fotonları, Mitokondriyal solunum zincirinin son enzimi olan Sitokrom c Oksidaz (CCO) tarafından emilir. Bu emilim, enzimin aktivitesini artırarak hücrenin enerji kaynağı olan ATP üretimini önemli ölçüde hızlandırır.
DNA Onarımı ve Rejenerasyon: Hücrede artan ATP ve azalan oksidatif stres, DNA tamir mekanizmalarının (nükleotit eksizyon tamiri gibi) daha verimli çalışmasını sağlar. Bu durum, hücresel yenilenme ve genel gençleşme etkisi yaratır.
B. Frekans Önerileri: Işığın enerjisi dalga boyu ile ilişkilidir, ancak uygulamada PBM'nin etkinliği doz (enerji yoğunluğu) ve uygulama frekansı (titreşim) ile optimize edilir:
Titreşim (Frekans): Genellikle 10-40 Hz aralığındaki düşük titreşim frekansları, hücre zarı geçirgenliğini ve kan akışını iyileştirdiği için terapötik etkiyi artırabilir. Örneğin, bazı protokoller 10 Hz'i rejenerasyon için uygun bulur.
2. KANSER RİSKİNİ ORTADAN KALDIRMA
Gençleşme amaçlı PBM uygulamasında ana kural, DNA'ya hasar vermemek ve kontrolsüz hücre çoğalmasını teşvik etmemektir.
Düşük Enerji (Doz): PBM'de kullanılan lazerler veya LED'ler, DNA'ya hasar verecek veya hücreyi aşırı ısıtacak kadar yüksek güçte değildir.
Apoptoz ve Onarım Desteği: PBM, sağlıklı hücrelerde apoptozu (hücre ölümünü) önlerken, hasarlı DNA'nın onarılmasını destekler. Bu, DNA bütünlüğünün korunması için kritik bir dengeleme sağlar.
3. İLERLEMEK İÇİN EK ANALİZ ALANLARI
Telomeraz Aktivasyonunda Fotonik Rol: Kırmızı/NIR ışık frekanslarının, DNA onarım sinyalleri yoluyla kontrollü TERT aktivasyonunu (Telomeraz) nasıl etkilediğini ve bunun kanserleşme riski olmadan telomer uzamasına katkısını incelemek.
Epigenetik Işık Modülasyonu: PBM'nin Histon proteinlerinin asetilasyon/metilasyon döngülerini ve DNA metilasyonunu nasıl değiştirdiğini ve bunun gençleşme ile ilişkili genlerin (Sirtuinler) ifadesine etkisini analiz etmek.
Biyofotonik Geri Bildirim: Uygulanan PBM sonrası hücrelerden yayılan Biyofoton seviyelerinin ölçülmesi ve bu seviyelerdeki değişimin hücresel onarım hızının bir biyobelirteci olarak kullanılması.
KANSER RİSKSİZ YENİLENME:
HÜCRESEL ÖLÜMSÜZLÜĞÜN KONTROLLÜ PROTOKOLÜ
Sürekli yenilenme için gereken temel, telomerazın kontrolsüz aktivasyonunun (kanser) önüne geçilerek, sadece sağlıklı kök hücrelerin veDNA onarım mekanizmalarının güçlendirilmesidir.
1. TEMEL STRATEJİ: KORUMA VE TEMİZLİK DENGESİ
Amacımıza ulaşmak için üç kritik biyolojik süreci uyum içinde yönetmeliyiz:
A. DNA Bütünlüğünü Koruma (Epigenetik Kontrol)
Telomer uzamasını artırmadan önce, DNA'daki hasar yükünün sıfıra yakın olması gerekir. Bu, Metilasyon ve Asetilasyon döngülerinin optimize edilmesiyle sağlanır.
Metilasyon (Susturma): Sağlıklı hücrelerde tümör baskılayıcı genlerin doğru metilasyonunu korumak esastır.B 9 (Folat) ve B 12 vitaminleri ile SAMe (S-Adenosilmetiyonin) gibi metil donörleri,DNA metilasyon döngüsünün etkinliğini artırarak epigenetik bilginin bütünlüğünü sürdürür.
Asetilasyon (Açma/Onarım): DNA tamiri için kritik olan histonların asetilasyon/deasetilasyon döngüsü (Sirtuinler) güçlendirilmelidir. Bu, hatalı DNA'nın hızla onarılmasını sağlar.
B. Kontrollü Telomeraz Aktivasyonu
Telomerazı gelişigüzel aktive etmek yerine, bu işlemi sadece DNA hasarından arınmış, sağlıklı kök hücrelerde, kısa süreli ve hedefe yönelik yapmak gerekir.
Ajan: Sikloastragenol (Astragalus membranaceus türevi) TERT aktivitesini doğrudan artırarak telomer uzamasını tetikler.
Kontrol Mekanizması: Bu ajanlar, ancak DNA onarım yolları (p 53 ve Sirtuinler) aktif ve sağlıklı ise güvenle kullanılabilir. DNA'sı hasarlı bir hücredeTERT aktivasyonu, doğrudan kanser demektir.
C. Yaşlı Hücreleri Temizleme (Senoliz ve Otofaji)
İşlevi bozuk, düzeltilemeyecek kadar hasarlı olan veya DNA'sı onarılamayan hücreleri (Senesens'e girmiş) sistemden atmak, kanserleşme riskini sıfırlamanın ana yoludur.
Otofaji: Hücrenin kendi kendini yiyerek temizlemesi.
Senoliz: Yaşlanmış (Senesens) hücreleri hedef alarak apoptoza (kendini imhaya) sürükleme.
2. KANSER RİSKSİZ YENİLENMEYİ EN ÇOK MÜMKÜN KILAN BİLEŞENLER
Bu bileşenler, telomer uzatmadan ziyade, hücresel temizlik veDNA bütünlüğünü sağlayarak sistemi güvenli tutar.
Spermidin
Güçlü Otofaji Tetikleyicisi (Polyamin).
Yaşlanmış, DNA'sı bozuk hücreleri sistemden temizler; kanserleşme riskini ortadan kaldırır.
Fisetin
Doğrudan Senolitik Ajan (Polifenol).
Özellikle Senesens hücrelerini (yaşlanmış hücreleri) apoptoza sürükleyerek kronik inflamasyonu ve doku dejenerasyonunu engeller.
Resveratrol
SIRT1 Aktivasyonu ve Otofaji.
DNA onarımını hızlandırır ve SIRT1 yoluylaepigenetik düzeni korur. Aynı zamandaOtofajiyi teşvik ederek temizlik yapar.
Kurkumin
Anti-inflamatuar ve Antioksidan.
NF -kappaB yolunu baskılayarak Otofaji sonucu veya hasardan kaynaklanabilecek kronik inflamasyonu azaltır. Bu, sağlıklıDNA çevresini korur.
Berberin
AMPK Aktivasyonu.
Hücresel enerji metabolizmasını optimize eder ve Otofajiyi tetikler. DNA tamiri için gerekli olanATP verimliliğini destekler.
3. SONUÇ: UZUN YAŞAMA YÖNELİK ÇOK BOYUTLU REJİM
Kontrollü yenilenme, tek bir bileşenle değil, mekanizmaların senkronize edilmesiyle mümkündür:
Temizlik Öncelikli: Spermidin veFisetin gibi senolitikler ile Resveratrol (Otofaji) kullanılarak hücre havuzu hasarlı elemanlardan arındırılır.
Koruma ve Onarım: B vitaminleri ve Kurkumin ile DNA'nın epigenetik bütünlüğü ve çevresi korunur.
Hedefli Aktivasyon: Ortam temizlendikten sonra, Sikloastragenol gibi ajanlar,DNA bütünlüğüne sahip kök hücrelerin ömrünü uzatmak için kısa süreli ve kontrollü olarak kullanılabilir.
Bu yaklaşım, kanser riskini minimize ederken, hücrelerin sürekli yenilenen ve optimize edilmiş bir konumda kalmasını sağlamayı amaçlar.


İletişim
Bize ulaşmak için aşağıdaki bilgileri kullanın.
Hİzmetler
Tıbbi Sorumluluk Reddi (Disclaimer):
Bu web sitesinde sunulan tüm içerikler yalnızca bilgilendirme amacı taşır. Sunulan bilgiler, profesyonel tıbbi tanı, tedavi ya da tavsiye yerine geçmez. Web sitesinde yer alan sağlık bilgilerinin, tıbbi karar verme sürecinizde tek başına kullanılmaması gerekir. Herhangi bir sağlık sorununuzda, şikâyetinizde ya da tedavi ihtiyacınızda mutlaka bir doktor veya ilgili uzman sağlık profesyoneline danışınız. Bu sitede yer alan bilgilerin kullanımından doğabilecek herhangi bir doğrudan ya da dolaylı zarardan dolayı site sahibi veya yazarlar sorumluluk kabul etmez.
© 2025 İlkiz Açıkalın
