"Bitkisel Kozmetik"
İnsülin Direnci ve Kronik Hastalıklarla İlişkisi
Dr. Aleksi
10/18/202514 min oku
İnsülin Direnci ve Kronik Hastalıklarla İlişkisi
Son 20–25 yılda, insülin direnci ve buna bağlı kronik hastalıkların görülme sıklığı dramatik biçimde artmıştır.
Basit karbonhidrat ağırlıklı beslenme, hareketsizlik, stres, uyku düzensizliği ve biyolojik saat bozuklukları,
bu metabolik sorunun temel nedenleridir.
Toplumun büyük bir kısmında — bazı çalışmalara göre %60’tan fazlasında — insülin direnci mevcuttur.
Ancak bu durum genellikle belirtiler hafif ve sinsi ilerlediği için uzun yıllar fark edilmez.
İnsülinin Rolü
İnsülin, pankreas tarafından üretilen ve hücrelerin glikozu (şekeri) enerjiye dönüştürmesini sağlayan hayati bir hormondur.
Karaciğer, kas ve yağ hücrelerinde besinlerin depolanması ve enerjiye çevrilmesi insülinin kontrolündedir.
Ancak bu hücreler zamanla, yüksek şeker ve insülin seviyelerine maruz kalmaya başlarsa,
kendilerini korumak için insüline duyarlılıklarını azaltır.
İşte bu duruma insülin direnci denir.
Kısır Döngü Nasıl Başlar?
Hücreler insüline duyarsızlaştığında, pankreas daha fazla insülin salgılayarak bu direnci aşmaya çalışır.
Sonuçta kandaki insülin düzeyi yükselir; fakat hücreler bu sinyali giderek daha az duyar.
Bu durum, yüksek insülin – düşük etkinlik döngüsüne yol açar.
Başlangıçta kan şekeri normal görünse bile, bu “denge” pankreasın aşırı çalışması sayesinde korunur.
Fakat pankreas bir süre sonra tükenir.
İnsülin üretimi yavaşlar veya hücreler tamamen yanıtsız hale gelir.
İşte o noktada tablo artık Tip 2 diyabet olarak karşımıza çıkar.
Bu süreç genellikle yıllar öncesinden başlayan bir insülin direncinin sonucudur.
Diyabet tanısı konmadan önce bile kişi, yüksek insülin düzeyi nedeniyle diyabetin tüm komplikasyonlarına (damar hasarı, inflamasyon, oksidatif stres) maruz kalır.
Kronik Hastalıkların Temelinde Ortak Mekanizma
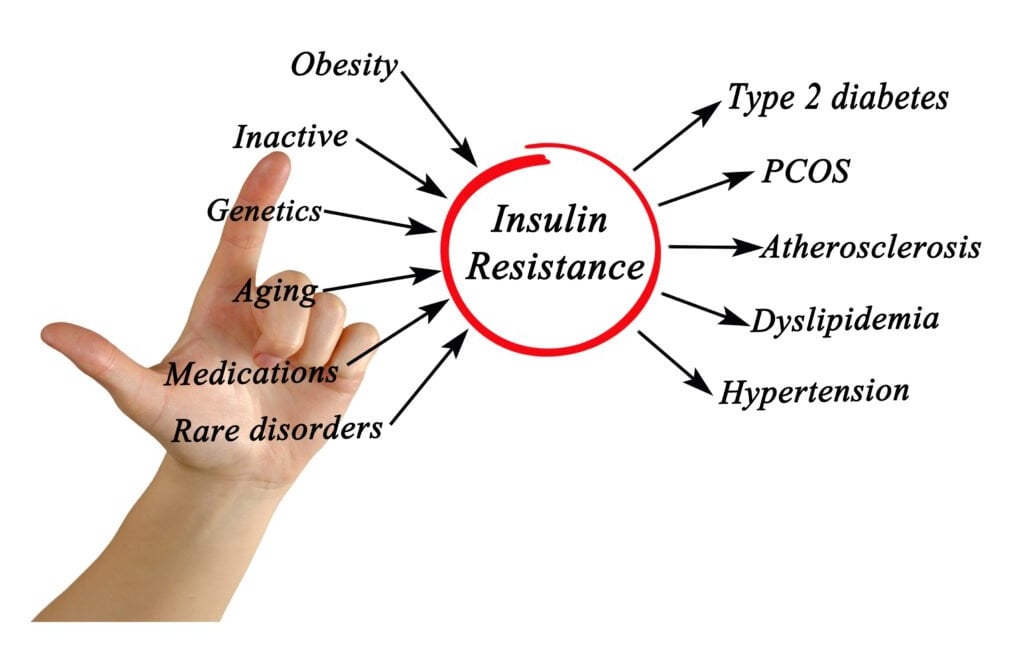
İnsülin direnci, yalnızca diyabetin değil, aynı zamanda birçok kronik hastalığın temelini oluşturur:
Ateroskleroz (damar sertliği)
Hipertansiyon
Obezite ve metabolik sendrom
Alzheimer ve nörodejeneratif hastalıklar
Polikistik over sendromu (PCOS)
Kronik inflamasyon ve otoimmün süreçler
İnsülin, yalnızca glikozu değil, yağ ve protein metabolizmasını da düzenler.
Dolayısıyla insülin direnci geliştiğinde, yağ depolanması artar, hücre içi enerji üretimi bozulur,
oksidatif stres ve iltihaplanma kronik hale gelir.
Enerji Metabolizması ve Hücresel Denge
İnsülin direnci geliştiğinde hücreler enerji kaynağı olarak glikozu etkili kullanamaz.
Mitokondriler — yani hücrenin enerji santralleri — bu durumda yağ asitlerini yakıt olarak kullanmak zorunda kalır.
Yağ yakımı, glikoz yakımına kıyasla daha temiz ve verimli bir enerji sağlar; daha az serbest radikal üretir.
Oysa sürekli karbonhidrat ağırlıklı beslenmede mitokondriler aşırı glikoz yüküyle boğulur.
Bu da proteinlerin glikasyonuna, yani “şekerlenmesine” neden olur.
Bu süreç, hücrelerin yaşlanmasına, dokuların sertleşmesine, Alzheimer gibi nörodejeneratif hastalıklara ve erken yaşlanmaya yol açar.
Metformin ve Tedavi Yaklaşımı Üzerine
Klasik tıpta insülin direnci genellikle metformin gibi ilaçlarla tedavi edilmeye çalışılır.
Ancak bu ilaçlar tek başına kalıcı çözüm sunmaz.
Çünkü insülin direncinin nedeni ilaç eksikliği değil, yaşam tarzı dengesizliğidir.
Metformin bazı hastalarda metilasyon dengesini bozabilir,
DAO enzimi aktivitesini azaltarak histamin birikimine ve kronik inflamasyona yol açabilir.
Yani, yanlış kullanıldığında enflamasyonu azaltmak yerine artırabilir.
Gerçek iyileşme, ilaçtan çok daha derin bir yerde başlar:
beslenmenin düzenlenmesi, insülin salınımını uyaran gıdalardan uzak durulması,
hareketin artırılması, uyku ve sirkadiyen ritmin dengelenmesi gerekir.
İnsülin Duyarlılığını Artırmak: Gerçek Çözüm
Rafine karbonhidrat ve şeker tüketimini azaltmak
Düşük glisemik indeksli besinleri tercih etmek
Yeterli protein ve sağlıklı yağ tüketmek
Günlük fiziksel aktiviteyi artırmak
Stres yönetimi ve kaliteli uyku düzeni sağlamak
Bu değişikliklerle hücreler yeniden insüline duyarlı hale gelir, kan şekeri dengesi sağlanır ve kronik inflamasyon azalır. İnsülin direnci, yalnızca bir hormonal dengesizlik değil, modern yaşam tarzının biyolojik bedelidir.
Vücudun bu direnci geliştirmesi, aslında kendini koruma mekanizmasıdır. Ancak bu korunma hali uzun sürerse, sistem kendi dengesini kaybeder. Gerçek tedavi, bu biyolojik isyanın nedenini anlamakla başlar. Yani sadece şekeri değil, yaşamın bütün ritmini yeniden dengelemekle.
İnsülin Direnci ve Kronik Hastalıklarla İlişkisi:
Son 20–25 yılda insülin direnci ve buna bağlı kronik hastalıklar (obezite, diyabet, hipertansiyon, kalp-damar hastalıkları, hormonal bozukluklar) hızla artmıştır.
Bu artışın temelinde yüksek karbonhidrat ve şeker tüketimi, hareketsizlik, stres, uyku bozuklukları ve biyolojik saatin bozulması yer alır.
Toplumun yaklaşık %60’ında insülin direnci olduğu tahmin edilmektedir — hatta birçok kişide bu durum sinsi şekilde ilerlediği için fark edilmeden yıllarca devam eder.
İnsülin Nedir ve Görevi Nedir?
İnsülin, pankreas tarafından salgılanan hayati bir hormondur.
Kandaki glukoz (şeker) ve diğer besin maddelerinin karaciğer, kas ve yağ dokusunda depolanmasını sağlar.
Kısaca insülin, kan şekerini düşüren değil, enerjiyi depolayan (anabolik) bir hormondur.
Kan şekerini düşürmesi, aslında depolama görevini yerine getirirken ortaya çıkan doğal bir sonuçtur.
Evrimsel olarak insülinin amacı; bolluk döneminde enerji depolamak, kıtlık döneminde hayatta kalmayı sağlamaktır.
Atalarımızın kıtlık zamanlarını atlatabilmesinde bu mekanizma yaşamsal bir rol oynamıştır. Ancak modern çağda sürekli gıda bolluğu ve az hareket, bu sistemi bozmuştur.
İnsülin Direnci Nedir?
İnsülin direnci, hücrelerin insülinin sinyallerine duyarsız hale gelmesidir.
Karaciğer, kas ve yağ hücreleri insüline gerektiği gibi cevap vermez; bu durumda kan şekeri düşmez, pankreas da daha fazla insülin üretir.
Zamanla kan insülin seviyesi kronik olarak yüksek kalır ve bu tablo hiperinsülinemi olarak adlandırılır.
Hücreler bu yüksek insüline karşı kendilerini korumak için reseptör sayısını azaltır veya duyarlılığını düşürür.
Bu durum bir kokuya alışmak gibidir: Sürekli kötü kokulu bir ortamda kalan biri kokuyu fark etmez hale gelir. Hücreler de tıpkı buna benzer biçimde insüline alışır ve tepki vermez olur.
İnsülin Direncini Düşündüren Belirtiler
Aşağıdaki bulguların birçoğu insülin direncinin habercisidir:
Göbek çevresinde yağlanma, kilo verememe
Sürekli acıkma, tatlı krizleri
Yemek sonrası uyku hali
Sabah yorgun kalkma, enerji düşüklüğü
Beyin sisi (konsantrasyon güçlüğü)
Ellerde titreme, üşüme, soğuk terleme
Sinirlilik, çarpıntı, baygınlık hissi
Adet düzensizliği, tüylenme, sivilce
Ciltte koyulaşma (özellikle boyun, koltuk altı gibi bölgelerde)
Bu belirtiler uzun süredir devam ediyorsa insülin direnciniz olabilir.
İnsülin Direnci Hangi Hastalıkların Temelindedir?
İnsülin direnci, modern çağın neredeyse tüm kronik hastalıklarının zeminini oluşturur:
Tip 2 Diyabet
Obezite ve metabolik sendrom
Hipertansiyon ve damar sertliği (ateroskleroz)
Kalp-damar hastalıkları
Polikistik Over Sendromu (PCOS)
Alzheimer (Tip 3 Diyabet olarak da anılır)
Kanser ve kronik inflamasyon
Yüksek insülin seviyeleri, hücresel düzeyde sürekli bir “büyüme ve depolama sinyali” gönderir.
Bu da kronik enflamasyon, oksidatif stres ve mitokondriyal disfonksiyon gibi yaşlanmayı hızlandıran süreçleri başlatır.
İnsülin Yüksekliği Nasıl Kronik Hastalık Yaratır?
Yağ Yakımını Engeller:
İnsülin yüksekliği, yağ hücrelerinin enerjiye dönüşümünü engeller.
Bu yüzden “aç kalsam da kilo veremiyorum” diyenlerin çoğunda gizli insülin direnci vardır.Kas Kaybına Yol Açar:
Vücut yağdan enerji üretemediği için kas proteinlerini şeker elde etmek için yakar.
Bu süreç “glukoneogenez” olarak adlandırılır ve uzun vadede kas kaybına yol açar.Kronik Stres Döngüsü Oluşturur:
Fazla şeker alımı → kan şekeri hızla yükselir → insülin artar → şeker düşer → stres hormonları (kortizol, adrenalin) salgılanır.
Bu sürekli döngü hem fiziksel hem zihinsel yorgunluğa sebep olur.Enflamasyonu Artırır:
Yüksek insülin ve glikoz, damar duvarlarında oksidatif hasar ve inflamasyona yol açar.
Bu da kalp, böbrek ve beyin damarlarını etkiler.
İnsülinin Diğer Görevleri
İnsülin yalnızca glukozu hücreye sokmaz; aminoasitleri, magnezyumu ve diğer mineralleri de hücre içine taşır.
Bu nedenle insülin direnci olan kişilerde:
Kas yapımı yavaşlar,
Hücre içi magnezyum eksikliği gelişir,
Yorgunluk, kas krampları ve sinirsel gerginlik artar.
Magnezyum, enerji üretimi (ATP sentezi), kas gevşemesi ve sinir iletimi için zorunludur.
İnsülin direnci geliştiğinde hücre içine magnezyum girişi bozulur, bu da enerji düşüklüğü ve kronik yorgunluk yaratır.
Tanı ve Klinik Değerlendirme
İnsülin direncini saptamak için en sık kullanılan yöntem HOMA-IR testidir:
HOMA = (İnsülin (µU/ml) × Glukoz (mg/dl)) / 405
<1.5 → Normal
2.0 → Direnç başlangıcı
2.5 → Belirgin insülin direnci
Daha hassas ama araştırma düzeyinde kullanılan yöntem öglisemik-hiperinsülinemik klemp testidir.
Açlık insülin düzeyinin 5 µIU/mL altında olması ideal kabul edilir.
HOMA-IR testi (Açlık glukozu x açlık insülini / 405) ≥2.5 ise insülin direnci düşünülmelidir.
Trigliserid yüksekliği, HDL düşüklüğü ve karın çevresinde yağlanma da tanıyı destekler.
Tedavi Yaklaşımı
İnsülin direnci “ilaç eksikliği” değil, yaşam tarzı bozukluğu hastalığıdır.
Tedavinin temeli:
Şeker ve rafine karbonhidratların azaltılması
Zaman kısıtlı beslenme (intermittent fasting)
Kas aktivitesini artıran düzenli egzersiz
Stres yönetimi ve kaliteli uyku
Mineral desteği (özellikle magnezyum ve krom)
Metformin gibi ilaçlar bazı vakalarda geçici destek sağlayabilir, ancak altta yatan beslenme ve yaşam tarzı düzeltilmedikçe kalıcı iyileşme beklenemez.
İnsülin direnci, görünmeyen ama derinden yıpratan bir metabolik dengesizliktir. Erken dönemde fark edilip düzeltilmezse, yıllar içinde diyabet, hipertansiyon, kalp hastalığı, hormonal bozukluklar ve hatta kanser riskini artırır.
Aslında vücudun bize verdiği mesaj nettir: “Artık yeter, sistem aşırı yüklendi!”
Bu nedenle, sağlıklı bir metabolizma için insülin duyarlılığını korumak; doğru beslenme, düzenli hareket ve stres yönetimiyle mümkündür.
Magnezyum, İnsülin ve Hücresel Dengenin Kırılma Noktası
Hücrelerimizin iç ortamı, yaşamın sürdürülebilmesi için son derece hassas bir iyon dengesine dayanır. Bu dengenin en kritik unsurlarından biri magnezyumdur. Magnezyum, enerji üretiminde görev alan ATP molekülünün aktif formuna bağlanarak, yaklaşık 300’den fazla enzimin çalışmasını düzenler. Eğer hücre içine yeterince magnezyum giremezse, enerji üretimi aksar ve hücre “enerji yoksunluğu” yaşar.
1. Magnezyum Eksikliği ve Damar Sistemi
Magnezyum eksikliği, damar düz kaslarında gevşemenin bozulmasına ve vazokonstrüksiyona (damar daralması) yol açar. Bu da kan basıncını yükselterek hipertansiyona neden olur. Aynı zamanda hücresel enerji üretimi yetersiz hale geldiği için kalp, kas ve beyin dokusu gibi yüksek enerji gerektiren organlar işlevsel olarak zorlanmaya başlar.
2. Magnezyum ve İnsülin İlişkisi
Magnezyum, insülinin hücre zarındaki reseptörüne bağlanabilmesi ve bu sinyalin hücre içine iletilebilmesi için gereklidir.
Bu nedenle iki yönlü bir etkileşim vardır:
İnsülin yükseldiğinde magnezyum böbrekten daha fazla atılır.
Magnezyum azaldığında hücreler insüline direnç geliştirir.
Bu döngü kırılmazsa hücre düzeyinde tam bir metabolik kaos başlar. Enerji üretimi azalır, damarlar daralır, insülin seviyesi yükselir ve sistemik inflamasyon artar.
3. Epigenetik Miras ve İnsülin Direnci
Araştırmalar, anne karnındaki beslenme koşullarının bile fetüsün ileriki yaşamında insülin duyarlılığını etkilediğini göstermiştir. Gebelikte aşırı şeker ve karbonhidrat alımı, fetüste bile insülin direnci oluşturabilir. Eğer fetüs dişi ise, bu direnç onun yumurtalarına da aktarılabilir. Bu durum, epigenetik aktarımın klasik bir örneğidir; yani genetik kod değişmeden, çevresel koşullar biyolojik eğilimleri şekillendirir.
4. Elektrolit Dengesi ve Kardiyovasküler Etkiler
Magnezyum, potasyum ve kalsiyumla birlikte iyonik dengeyi sağlar. Magnezyum azaldığında hücre içine kalsiyum fazlaca girer, bu da damar kaslarında kasılma yaratır. Aynı zamanda sodyum tutulumu artar ve sıvı birikimi oluşur. Sonuçta yüksek tansiyon ve konjestif kalp yetmezliği riski artar.
5. Otonom Sinir Sistemi ve İnsülin
İnsülin, sempatik sinir sistemini (stres yanıtı) uyarır. Karbonhidrat açısından zengin bir öğün sonrası insülinin ani yükselmesi, adrenalin ve kortizol salınımını artırır. Bu da nabız ve tansiyonu yükselterek kalp krizi riskini geçici olarak 2-3 kat artırabilir.
Yani insülin sadece bir “şeker hormonu” değil, nörovejetatif sistemi etkileyen bir stres aracısıdır.
6. Karaciğer, Kas ve Yağ Dokusu: Üçlü Direnç Halkası
İnsülin direnci öncelikle karaciğerde başlar.
Karaciğer artık insüline yanıt veremediğinde, gece boyunca kana gereğinden fazla glukoz verir.
Kas hücreleri şekerin hücre içine girmesini sağlayamaz, enerji üretimi düşer.
Yağ hücreleri ise hâlâ insüline yanıt verir ve fazla glukozu yağ olarak depolar.
Bu süreç ilerledikçe obezite, hiperinsülinemi ve diyabet ortaya çıkar.
7. İnsülinin Damar ve Tümör Hücreleri Üzerindeki Etkisi
İnsülin “mitojenik” bir hormondur; yani hücre bölünmesini uyarır. Fazla insülin, damar iç yüzeyindeki endotel hücrelerinin aşırı çoğalmasına yol açar ve aterosklerotik plak oluşumunu başlatır.
Aynı mekanizma kanser hücrelerinin büyümesini de hızlandırabilir. Bu nedenle hiperinsülinemi, kardiyovasküler hastalıklar ve bazı kanser türlerinde ortak bir risk faktörüdür.
8. Tiroid ve Hormonel Sistem Üzerindeki Etkiler
İnsülin direnci, karaciğerde T4 hormonunun T3’e dönüşümünü azaltır; bu da “sessiz hipotiroidi”ye yol açar. Ayrıca seks hormon bağlayıcı globulin (SHBG) sentezini artırarak cinsiyet hormonlarının serbest (aktif) fraksiyonunu düşürür. Sonuç: hormonal dengesizlik, kısırlık, libido azalması ve adet düzensizlikleri.
9. Kalsiyum Metabolizması ve Kemik Sağlığı
İnsülin direnci kemik yapımını destekleyen anabolik hormonların (IGF, testosteron, DHEA) aktivitesini bozar. Kalsiyum kemik yerine yumuşak dokulara birikmeye başlar — bu da damar kireçlenmesi (metastatik kalsifikasyon) riskini artırır.
10. Yaşlanma, Hücresel Hasar ve Şeker
Yaşlanmanın biyokimyasal temelinde insülin duyarlılığının azalması yatar. Yüksek insülin, hücrelerin ömrünü kısaltan oksidatif stres ve glikasyon süreçlerini hızlandırır.
Basit karbonhidratlar, özellikle fruktoz ve galaktoz, glukozdan daha sessiz ama daha yıkıcı etkilere sahiptir; çünkü kan şekeri ölçümlerinde görünmezler, ama hücre içinde insülini uyararak yaşlanmayı hızlandırırlar.
Sonuç: Hücre Düzeyinde Dengeyi Korumak, Yaşamı Korumaktır
Magnezyum, insülin ve enerji metabolizması arasındaki denge bozulduğunda, hücre iletişimi zayıflar ve yaşlanma süreci hızlanır.
Bu yüzden sağlık, yalnızca laboratuvar değerlerinde değil, hücre zarının geçirgenliğinde, iyonların dansında, enerjinin akışında gizlidir.
Bütüncül tıp bu yüzden şunu öğretir:
“Şifanın kaynağı, kimyasal bir madde değil, hücresel bilincin yeniden uyumlanmasıdır.”
Oksidasyon, Glikasyon ve Yaşlanmanın Biyokimyasal Anatomisi
Yaşlanma, yalnızca zamanın geçişiyle değil, hücresel düzeyde biriken mikro hasarların toplamıyla gerçekleşir. Bu hasarın iki ana biyokimyasal kaynağı vardır: oksidasyon ve glikasyon.
1. Oksidasyon: Hücre Paslanması
Oksidasyon, bir molekülün elektron kaybetmesi anlamına gelir. Tıpkı demirin oksijenle temas ettiğinde paslanması gibi, hücre içindeki yağlar, proteinler ve DNA da serbest radikaller tarafından oksitlenir.
Bu radikaller —özellikle süperoksit (O₂⁻), hidroksil (•OH) ve hidrojen peroksit (H₂O₂)— mitokondride enerji üretimi sırasında ortaya çıkar. Antioksidan savunma sistemi (glutatyon, süperoksit dismutaz, katalaz, E ve C vitamini) bu molekülleri nötralize eder. Ancak bu sistem yetersiz kaldığında, radikaller hücre zarına, DNA’ya ve proteinlere saldırır.
Sonuç: mitokondriyal yorgunluk, genetik hasar ve yaşlanmanın ivmelenmesi.
2. Glikasyon: Şekerin Sessiz Yakması
Glikasyon, şeker moleküllerinin (özellikle glukoz ve fruktoz) proteinlere, lipidlere veya DNA’ya enzimsiz bir şekilde bağlanmasıdır.
Bu süreçte Advanced Glycation End Products (AGEs) adı verilen yapışkan bileşikler oluşur.
AGE’ler tıpkı karamelize olmuş şeker gibi proteinleri yapısal olarak sertleştirir ve fonksiyonlarını bozar. Kollajen, elastin, miyelin, hemoglobin gibi uzun ömürlü proteinler bu saldırının başlıca hedefleridir.
AGE’lerin biriktiği dokularda:
Kollajen esnekliğini kaybeder → cilt kırışır, damarlar sertleşir.
Sinirlerde glikoz toksisitesi → nöropati gelişir.
Eklem kıkırdakları kırılgan hale gelir → osteoartrit ve disk dejenerasyonu başlar.
Böbrek glomerülleri ve retina zarar görür → diyabetik nefropati ve retinopati oluşur.
3. Glikasyonun Enflamatuvar Zinciri: Makrofajlar ve Sitokinler
AGE’ler sadece mekanik hasara yol açmaz; bağışıklık sistemini de alarma geçirir.
Makrofajlar, AGE’leri tanıyıp fagosite etmeye çalışırken proinflamatuvar sitokinler (IL-6, TNF-α, CRP) salgılar.
Bu kimyasallar damar geçirgenliğini artırır, kronik doku enflamasyonu oluşturur ve zamanla otoimmün süreçleri tetikler. Yani şekerle karamelleşmiş proteinler bağışıklık sistemi tarafından mikroorganizma gibi algılanır. Vücut kendi dokusuna saldırmaya başlar. Bu nedenle glikasyon, “steril inflamasyon” olarak adlandırılır.
4. Glikasyonun Mikroskobik Sonuçları
DNA Glikasyonu: Genetik kodda kırılmalar ve onarım hataları oluşur → yaşlanma ve kanser riski artar.
Mitokondri Hasarı: AGE’ler mitokondri zar proteinlerini sertleştirir → enerji üretimi azalır.
Endotelyal Disfonksiyon: Damar iç yüzeyi oksidatif stres altında nitrik oksit (NO) üretimini azaltır → damar sertliği (ateroskleroz) gelişir.
Kısacası, glikasyon biyolojik karamelizasyondur ve insan bedeni bu süreçte yavaşça “şekerlenerek yaşlanır.”
Yaşlanma = Karamelizasyonun biyokimyasal adı.
Uzun yaşamak istiyorsanız, hücrelerinizi karamelize etmeyin.
Diyabet, İnsülin ve Kısır Döngü
1. İnsülin Direncinin Kimyasal Gerçekliği
Tip-2 diyabetin temelinde insülin yetersizliği değil, insülin fazlalığı vardır.
Hücreler sürekli yüksek insüline maruz kaldığında reseptör duyarlılığı azalır, tıpkı yüksek sese alışmış bir kulak gibi. Sonuçta hücre kapıları kapanır, glukoz içeri giremez, kanda birikmeye başlar. Pankreas bu direnci aşmak için daha fazla insülin salgılar — kısır döngü budur.
Yüksek insülin seviyesi:
Karaciğerde yağ depolanmasını artırır → karaciğer yağlanması,
Damar iç yüzeyini kalınlaştırır → hipertansiyon,
Oksidatif stres ve glikasyonu hızlandırır → erken yaşlanma,
Beyinde insülin sinyalini bozar → beyin sisi ve Alzheimer riskini artırır.
2. İnsülin Tedavisinin Çelişkisi
Tip-2 diyabetin biyolojik sorunu insülin eksikliği değil, hücresel duyarsızlıktır.
Ancak klinik uygulamalarda insülin direncine rağmen ek insülin verilmesi, sorunu kökten çözmek yerine metabolik yükü artırır.
Fazla insülin:
Hücre içi yağ sentezini hızlandırır → kilo artışı,
Hipoglisemi ataklarına neden olur,
Oksidatif stres ve glikasyonu artırır → yaşlanmayı hızlandırır.
Daha önemlisi, bazı vakalarda vücut yabancı insüline karşı antikor geliştirir.
Bu otoimmün yanıt, pankreasın kendi β-hücrelerine saldırarak onları yok eder.
Sonuçta Tip-2 diyabetli birey sekonder Tip-1 diyabet haline gelir — ömür boyu insüline bağımlı.
Bu dönüşümün 6–12 ay gibi kısa sürede gelişebildiğini gösteren klinik veriler mevcuttur.
3. Gerçek Çözüm: Hücresel Duyarlılığı Yeniden Kazandırmak
Diyabetin kökeninde beslenme hataları, kronik stres, sedanter yaşam ve sirkadiyen ritim bozuklukları vardır.
İnsülin duyarlılığını geri kazanmak için:
Aralıklı oruç ve düşük glisemik indeksli diyet,
Düzenli aerobik ve direnç egzersizi,
Magnezyum, krom, alfa-lipoik asit ve polifenol takviyeleri,
Uyku hijyeni ve stres yönetimi uygulanmalıdır.
Bu yaklaşımla birçok hastada ilaç ve insülin ihtiyacı %80’in üzerinde azalmaktadır.
Sonuç: Yaşlanma, Şekerle Yazılmış Bir Zaman Günlüğüdür
Oksidasyon ve glikasyon, yaşlanmanın iki yönlü biyokimyasal imzasıdır:
Birinde hücre yanar, diğerinde karamelize olur. Ve bu süreçlerin merkezinde, insülinin sessiz fısıltısı vardır.
“İnsülin yalnızca bir hormon değil, yaşamın biyokimyasal yöneticisidir. Onun ritmini düzeltmek, zamanı yavaşlatmaktır.”
İletişim
Bize ulaşmak için aşağıdaki bilgileri kullanın.
Hİzmetler
Tıbbi Sorumluluk Reddi (Disclaimer):
Bu web sitesinde sunulan tüm içerikler yalnızca bilgilendirme amacı taşır. Sunulan bilgiler, profesyonel tıbbi tanı, tedavi ya da tavsiye yerine geçmez. Web sitesinde yer alan sağlık bilgilerinin, tıbbi karar verme sürecinizde tek başına kullanılmaması gerekir. Herhangi bir sağlık sorununuzda, şikâyetinizde ya da tedavi ihtiyacınızda mutlaka bir doktor veya ilgili uzman sağlık profesyoneline danışınız. Bu sitede yer alan bilgilerin kullanımından doğabilecek herhangi bir doğrudan ya da dolaylı zarardan dolayı site sahibi veya yazarlar sorumluluk kabul etmez.
© 2025 İlkiz Açıkalın
