"Bitkisel Kozmetik"
KANSER HÜCRESİNİ KENDİ SİLAHI 'SAPKIN GLİKOZİLASYON' İLE VURMAK
Dr. Aleksi
12/20/20255 min oku
HÜCRENİN ŞEKERDEN ZIRHI: KANSERİN GİZLİ DİLİ VE "GLİKO-İMMÜNOTERAPİ" DEVRİMİ
"Kanser hücreleri, bağışıklık sisteminden kaçmak için şeker moleküllerini (glikanları) bir 'görünmezlik pelerini' gibi kullanıyor. Ancak bilim, şimdi bu pelerini kaldırmanın yolunu buldu."
Analiz Sentezi: Martin Orlinov Kanev, Elvan Bakar (Trakya Üni.) & Dr. Jessica Stark, Prof. Carolyn Bertozzi (MIT/Stanford)
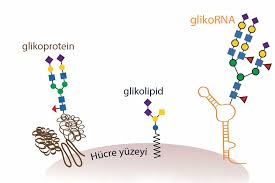
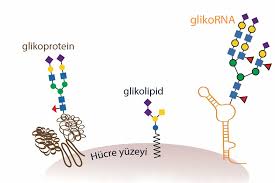
GİRİŞ: MİKROSKOBİK ORMAN (GLİKOKALİKS)
Vücudumuzdaki her hücrenin yüzeyi, çıplak bir zar değildir. Mikroskobik düzeyde bakıldığında, hücrelerin yüzeyi sık bir ormanı andırır. Bu orman, proteinlere ve yağlara (lipitlere) tutunmuş şeker zincirlerinden (Glikokonjugatlar) oluşur. Bilim insanları bu tabakaya "Glikokaliks" adını verir.
Bu şekerler sadece enerji deposu değildir; onlar hücrenin biyolojik kimlik kartıdır.
Hücreler birbirini bu şekerlerden tanır (Hücresel Sinyalizasyon).
Bağışıklık sistemi, "Dost musun, düşman mısın?" sorusunu bu şekerlere dokunarak sorar.
Embriyo gelişimi ve yaraların iyileşmesi bu şekerlerin sinyalleriyle yönetilir.
Ancak kanserleşme başladığında, bu masum şeker ormanı, bağışıklık sistemini kör eden ölümcül bir kamuflaja dönüşür.
BÖLÜM I: KANSERİN DÖNÜŞÜMÜ (SAPKIN GLİKOZİLASYON)
Kanser, DNA'daki bir hasarla başlar ama yayılmak (metastaz) ve hayatta kalmak için yüzeyindeki şekerleri değiştirmek zorundadır. Trakya Üniversitesi araştırmacılarının vurguladığı gibi, tümör dokularında "Aberan Glikozilasyon" (Sapkın Şekerleme) görülür.
Kanser hücresi, normal bir hücreden farklılaşmak için üç temel strateji izler:
Dallanma (Branching): Şeker zincirlerini uzatır ve karmaşıklaştırır. Bu, tümörün daha agresif ve tedaviye dirençli olmasına neden olur.
Negatif Yükleme (Elektrostatik İtme): Yüzeyini asidik şekerlerle kaplayarak güçlü bir eksi (-) elektrik yükü oluşturur. Bu itme kuvveti, kanser hücrelerinin birbirinden kopmasını ve kan dolaşımına karışarak yayılmasını (metastazı) kolaylaştırır.
Antijen Maskeleme: Bağışıklık sisteminin saldıracağı hedef noktaları (antijenleri) yoğun şeker tabakalarıyla örter.
BÖLÜM II: DÜŞMANIN SİLAHLARI (BİYOBELİRTEÇLER)
Kanser, bu biyolojik savaşta üç ana moleküler ajanı kullanır. Bunlar aynı zamanda bizim için hastalığı teşhis etmede kullanılan kritik ipuçlarıdır.
1. Sialik Asit: "Beni Yeme" Sinyali
Şeker zincirlerinin en ucunda bulunan, 9 karbonlu ve negatif yüklü bir moleküldür. Kanser hücreleri, yüzeylerini normalden katbekat fazla Sialik Asit ile kaplar.
Mekanizma (Siglec Tuzağı): Bağışıklık hücrelerimiz (NK hücreleri ve Makrofajlar), yüzeylerinde Siglec (Sialic acid-binding Ig-like lectins) adı verilen reseptörler taşır. Bu reseptörler, bağışıklık sisteminin "devriye polisleri" gibidir.
Kanserin Hilesi: Kanser hücresi, yüzeyindeki yoğun Sialik Asiti, polisin (bağışıklık hücresinin) Siglec reseptörüne bağlar. Bu bağlanma, polise şu sinyali gönderir: "Ben dostum, sakın ateş etme!" (Buna immünosupresyon denir).
Kanıt: Akciğer, meme, kolon ve yumurtalık kanserlerinde kandaki "Total Sialik Asit" (TSA) seviyeleri, tümör yüküyle doğru orantılı olarak artar [^1].
2. Fukoz: Sahte Pasaport ve Yapışkan
Fukoz, genellikle kan grubu antijenlerinde bulunan bir şekerdir. Ancak kanserde, özellikle Meme ve Kolorektal tümörlerde "G-Fukoz" fraksiyonu artar.
Görevi: Kanser hücresinin kan damarlarına tutunmasını ve dolaşıma katılarak başka organlara sıçramasını sağlayan bir "biyolojik yapışkan" görevi görür. Bu, metastazın ilk adımıdır.
3. Galektinler: İnşaat Ekibi ve Kalkan
Bunlar, şekerlere bağlanan özel proteinlerdir (Lektin ailesi).
Galektin-1: Tümörün etrafında yeni kan damarları oluşturmasına (Anjiyogenez) yardım eder, böylece tümör beslenir ve büyür.
Galektin-3: Kanser hücresinin programlı hücre ölümüne (apoptoz) gitmesini engeller. Yani hücreye "ölümsüzlük" verir.
BÖLÜM III: KARŞI SALDIRI (AbLecs DEVRİMİ)
Yıllarca bilim dünyası, kanserin bu "Sialik Asit Zırhını" biliyordu ama onu delemiyordu. Sialik asidi hedef alan moleküller (lektinler) kanser hücresine yeterince sıkı tutunamıyordu.
Ancak 2025 yılında MIT'den Dr. Jessica Stark ve Stanford'dan Nobel ödüllü Prof. Carolyn Bertozzi, "AbLecs" (Antibody-Lectin Chimeras) adını verdikleri hibrit bir molekül geliştirerek bu sorunu çözdüler. Bu, immünoterapinin 2.0 versiyonudur.
AbLecs Nasıl Çalışır? (Çift Kollu Kıskaç Stratejisi)
Bu molekül, genetik mühendisliği ile üretilmiş bir "Frankenstein" proteinidir (Kimera) ve iki kritik görevi aynı anda yapar:
Hedefleme Kolu (Antikor Kısmı): Molekülün bir yarısı, kanser hücresine özgü bir proteini tanır ve ona sıkıca yapışır (Örn: Meme kanserinde HER2 reseptörü). Bu sayede ilaç vücutta kaybolmaz, doğrudan tümöre kilitlenir. Buna "Avidite Etkisi" denir.
Blokaj Kolu (Lektin Kısmı): Normal antikorun bir kolu kesilip yerine, genetik olarak tasarlanmış bir Lektin (Siglec-7 veya Siglec-9 tuzağı) yerleştirilmiştir.
Görevi: Kanser hücresinin yüzeyindeki o tehlikeli Sialik Asitleri örter (maskeler).
Sonuç: Sialik asitler örtüldüğü için, bağışıklık hücresinin Siglec reseptörü bağlanacak yer bulamaz. "Ateş etme" emri iptal olur. Frenler boşalır ve bağışıklık sistemi tümörü yok etmeye başlar.
BÖLÜM IV: DENEYSEL KANITLAR VE MODÜLER GELECEK
Dr. Stark ve ekibinin çalışması, bu stratejinin bir teori olmaktan çıktığını kanıtladı:
Fare Deneyleri (In Vivo Kanıt): İnsan bağışıklık sistemine sahip olacak şekilde genetiği değiştirilmiş farelerde, akciğer metastazı yapmış agresif kanserlerde AbLec tedavisi uygulandı.
Sonuç: Sadece klasik antikor (Trastuzumab) verilen farelerde metastaz devam ederken, AbLec verilen farelerde tümörlerde ciddi küçülme ve bağışıklık aktivasyonu gözlemlendi.
Tak-Çalıştır (Modüler) Yapı: AbLecs teknolojisinin en büyüleyici yanı bir "Lego" gibi olmasıdır. Antikor kısmı değiştirilerek farklı kanser türlerine uyarlanabilir:
Meme Kanseri: Trastuzumab (HER2 hedefli).
Lenfoma: Rituximab (CD20 hedefli).
Kolorektal Kanser: Cetuximab (EGFR hedefli).
SON SÖZ: TIPTA YENİ BİR ÇAĞ "GLİKO-ONKOLOJİ"
Kanev ve Bakar'ın analizinde vurguladığı "Glikokonjugat değişimleri" artık sadece bir teşhis aracı değil, aynı zamanda bir tedavi hedefidir.
Mevcut immünoterapiler (Keytruda, Opdivo gibi PD-1 inhibitörleri) hastaların sadece %20-30'unda tam yanıt verirken, geri kalan hastalarda tümörler "PD-1 dışı" yollarla kaçmaya devam ediyordu. MIT ve Stanford'un geliştirdiği bu "Şeker Zırhını Delme" stratejisi, tedaviye dirençli kanserler için yeni bir umut ışığıdır.
Kanser, arkasına saklandığı şeker perdesini kaybettiğinde, bağışıklık sistemimiz karşısında çıplak ve savunmasız kalmaktadır. Bu çalışma, kanseri sadece genetik bir bozukluk olarak değil, aynı zamanda bir "yüzey kaplama (glikobiyoloji) problemi" olarak görmemiz gerektiğini kanıtlayan tarihi bir dönüm noktasıdır.
TERİMLER SÖZLÜĞÜ VE DİPNOTLAR
(1) Glikozilasyon: Hücre içindeki protein veya yağlara, enzimler aracılığıyla şeker moleküllerinin eklenmesi işlemi. Bu işlem hücrenin endoplazmik retikulumunda gerçekleşir.
(2) Metastaz: Kanser hücrelerinin doğdukları dokudan kopup, kan veya lenf yoluyla başka organlara sıçraması ve orada yeni tümörler oluşturması.
(3) İmmünoterapi: Kanseri doğrudan zehirlemek (kemoterapi) yerine, hastanın kendi bağışıklık sistemini kansere saldırması için eğiten ve güçlendiren tedavi yöntemi.
(4) Siglec (Sialic acid-binding Ig-like lectins): Bağışıklık hücrelerinde bulunan bir reseptör ailesi. Anahtarı (Sialik Asit) kilide soktuğunuzda, bağışıklık hücresine "sakin ol / saldırma" sinyali (inhibitör sinyal) gönderir.
(5) Kimera (Chimera): Genetik mühendisliğinde, iki farklı canlıdan veya molekülden alınan parçaların birleştirilmesiyle oluşturulan hibrit yapı. (Mitolojideki aslan başlı, keçi gövdeli yaratıktan gelir).
Referanslar:
Kanev, M. O., & Bakar, E. "Kanserde Glikokonjugatlar / Glycoconjugates in Cancer". Trakya Üniversitesi.
Stark, J. C., Bertozzi, C., et al. "Antibody–lectin chimeras for glyco-immune checkpoint blockade." Nature Biotechnology (2025).
İletişim
Bize ulaşmak için aşağıdaki bilgileri kullanın.
Hİzmetler
Tıbbi Sorumluluk Reddi (Disclaimer):
Bu web sitesinde sunulan tüm içerikler yalnızca bilgilendirme amacı taşır. Sunulan bilgiler, profesyonel tıbbi tanı, tedavi ya da tavsiye yerine geçmez. Web sitesinde yer alan sağlık bilgilerinin, tıbbi karar verme sürecinizde tek başına kullanılmaması gerekir. Herhangi bir sağlık sorununuzda, şikâyetinizde ya da tedavi ihtiyacınızda mutlaka bir doktor veya ilgili uzman sağlık profesyoneline danışınız. Bu sitede yer alan bilgilerin kullanımından doğabilecek herhangi bir doğrudan ya da dolaylı zarardan dolayı site sahibi veya yazarlar sorumluluk kabul etmez.
© 2025 İlkiz Açıkalın
