"Bitkisel Kozmetik"
Kanser Hücresinin Enerji Metabolizması ve Bir "Hack"lenme Hikayesi
Dr. Aleksi
12/15/20255 min oku
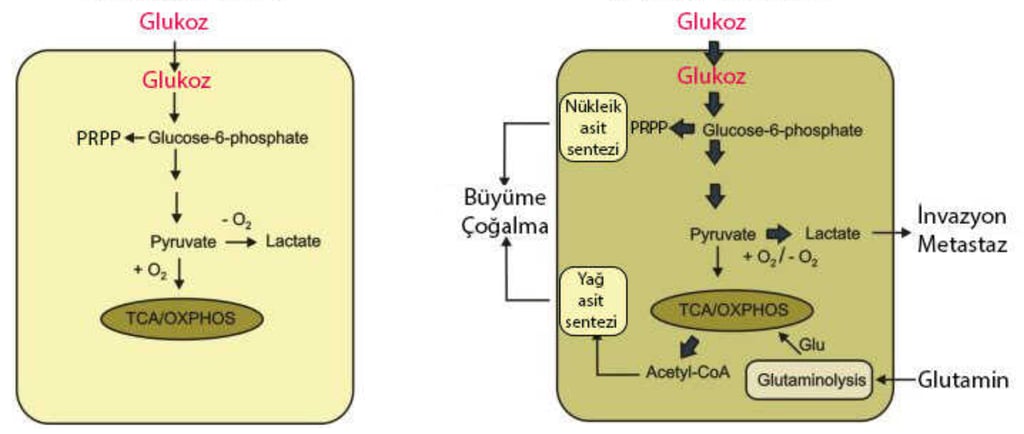
Kanser hücreleri glikozu yoğun olarak pentoz fosfat yolağında ve laktik asit fermantasyonunda kullanırlar. Yani glikozu basitçe işleyerek, fazla oksijene ihtiyaç duymadan düşük miktarda ATP (enerji) üretirler. Kanser hücreleri glikozu, aşağıda bahsedilecek olan Krebs döngüsüne sokmama eğilimindedir. Buna karşın, kandan daha fazla glikoz çekme kabiliyetine sahiptir. Kanser hücrelerinin glikozu pentoz fosfat yolağına yönlendirmesinin sebeplerinden biri, bu yolak ile pürin ve pirimidin nükleik asitlerini sentezlemesi için gerekli olan riboz şekerini üretmektir. Nükleik asit sentezi, sürekli olarak bölünen bu kanser hücreleri için olmazsa olmazdır. Bir diğer yolak olan laktik asit fermantasyonu ise farklı bir işleve sahiptir. Kanser hücreleri bu yolak ile ürettikleri laktik asiti intrasellüler aralığa salarak etrafındaki normal hücrelere zarar verirler ve böylece invazyon (etrafındaki dokuyu işgal) ve metastaz (uzaktaki dokuyu işgal) gibi fonksiyonlar kazanırlar. Ayrıca bu hücreler amino asitleri Krebs döngüsünde asetik KoA’ya dönüştürüp, asetil KoA’yı da hücre büyümesi ve bölünmesi için gerekli olan yağ asiti sentezinde kullanır.
Kanser Hücresinin Enerji Metabolizması ve Bir "Hack"lenme Hikayesi
Normal bir hücre, vücudun kurallarına uyan uysal bir vatandaştır. Enerjiyi verimli kullanır, işini yapar ve zamanı geldiğinde ölür. Ancak kanser hücresi, biyolojik bir anarşisttir. Amacı sadece hayatta kalmak değil; kuralsızca bölünmek (proliferasyon), kimlik değiştirmek (transformasyon) ve yeni topraklara göç etmektir (metastaz).
Bu devasa biyolojik operasyonu finanse etmek için standart enerji politikaları yetersiz kalır. İşte bu noktada kanser, "Metabolik Yeniden Programlama" adı verilen stratejik bir darbe ile hücrenin enerji santrallerini ele geçirir. Bu, basit bir adaptasyon değil; glukoz, lipid ve amino asit yolaklarının tamamen "hack"lenmesidir.
1. Büyük İhanet: Warburg Paradoksu ve Biyokütle İnşası
1931'de Otto Warburg, bilim dünyasını sarsan bir gariplik fark etti. Kanser hücreleri, oksijen havuzunda yüzseler bile (aerobik koşullar), glikozu mitokondride verimli bir şekilde yakmak yerine (36 ATP), sitoplazmada fermente etmeyi (2 ATP) seçiyorlardı.
Bir hücre neden enerjiden %95 zarar edeceği bir yolu seçsin?
Cevap, "Enerji" değil "Hammadde" ihtiyacında saklıdır. Kanser hücresi bir enerji santrali değil, devasa bir inşaat şantiyesidir.
İnşaat Sahası Analojisi: Bir gökdelen inşa ettiğinizi düşünün. Şantiyeye giren tüm keresteleri (glikoz) ısınmak için şöminede yakarsanız (ATP üretimi), binayı inşa edemezsiniz. Kanser hücresi, glikozu yakmak yerine, onu karbon iskeleti olarak kullanır.
Pentoz Fosfat Yolağına (PPP) Sapkınlık: Hücre, glikozu ana yoldan saptırarak bu yolağa sokar. Burada iki stratejik silah üretir:
Riboz-5-Fosfat: Hızla kopyalanan DNA ve RNA için gerekli olan nükleotidlerin (pürin/pirimidin) omurgası.
NADPH: Hücrenin kendi aşırı hızının yarattığı oksidatif strese (ROS) karşı bir kalkan ve hücre zarı inşası (yağ asidi sentezi) için kritik bir indirgeyici ajan.
Bu akış tesadüfi değildir. PFKFB4 enzimi ve SRC-3 (Steroid Reseptör Koaktivatörü-3) gibi moleküler tetikçiler, glikozun mitokondriye giriş vizesini iptal eder ve onu zorla biyosentez fabrikalarına yönlendirir.
2. Atık Değil, Kimyasal Silah: Laktat
Kanser hücresinin "verimsiz" fermantasyonu sonucu ortaya çıkan Laktat (Laktik Asit), uzun yıllar bir metabolik çöp sanıldı. Oysa bu, kanserin "Terraforming" (gezegen yüzeyini değiştirme) aracıdır.
Hücre dışına pompalanan laktat iki kritik görev üstlenir:
Asidik İnvazyon Yolu: Asit, tümör etrafındaki sağlıklı dokuyu adeta eriterek kanser hücresine göç (invazyon) yolları açar.
Bağışıklık Sis Perdesi: Asidik ortam, vücudun askerleri olan T-hücrelerini ve NK (Doğal Katil) hücrelerini sersemletir. Kanser, kendi yarattığı asit bulutunun içinde bağışıklık sisteminden saklanır.
3. Krebs Döngüsü: Enerji Santralinden Sinyal Kulesine Dönüşüm
Hans Krebs'in tanımladığı, mitokondrinin kalbindeki o meşhur döngü (TCA), kanser hücresinde artık sadece ATP üretmek için dönmez. Döngü kırılır, tersine döner veya yan yollarla beslenir (Anapleroz).
Kanser hücresi, özellikle Glutamin amino asidini kullanarak döngüyü besler. Burada biriken ara ürünler artık yakıt değil, birer "Onkometabolit"tir:
Süksinat, Fumarat ve 2-Hidroksiglutarat (2-HG): Bu moleküller biriktiğinde çekirdeğe "yanlış" raporlar gönderirler. Epigenetik enzimleri inhibe ederek genlerin işleyişini değiştirir ve tümörleşmeyi (tümörijenez) teşvik ederler.
Sahte Alarm: Bu metabolitler, ortamda oksijen olsa bile hücreye "Boğuluyoruz!" sinyali göndererek (HIF-1alpha'yı stabilize ederek) anjiyogenezi (yeni damar oluşumu) tetikler.
Bu mekanizma, Fonksiyonel Tıp yaklaşımıyla Diklorasetat (DCA) gibi ajanların neden işe yarayabileceğini açıklar. DCA, piruvatın mitokondriye girmesini engelleyen kilidi (PDK enzimini) kırarak, hücreyi "zorla" normal oksijenli solunuma döndürmeye çalışır. Yani kanseri, unuttuğu "normale" dönmeye zorlar.
4. Hipoksiye Adaptasyon: Oksijensizliğin Efendileri
Tümör o kadar hızlı büyür ki, kendi damar ağı bu hıza yetişemez ve merkezde derin bir oksijensiz (hipoksik) alan oluşur. Normal hücre burada ölürken, kanser hücresi 2019 Nobel Tıp Ödülü'ne konu olan mekanizmayla "Evrimleşir".
Bu adaptasyonun generali HIF-1alpha (Hipoksi İndüklenebilir Faktör) transkripsiyon faktörüdür:
Kapıları Aç: "Enerji verimim düştü, o zaman daha çok yakıt almalıyım" diyerek hücre yüzeyindeki glikoz kapılarını (GLUT-1) sonuna kadar açar.
Fırını Kapat: Mitokondrinin giriş kapısını (PDK-1 aracılığıyla) kilitler. Oksijenli solunumu tamamen kapatır ki, azıcık kalan oksijen diğer hayati işlere yarasın.
Bu keşif, Klinik Onkolojide yeni bir çağ açmıştır. HIF-2alpha inhibitörleri (Örn: Belzutifan), özellikle böbrek kanserlerinde bu "nefes alma" mekanizmasını bloke ederek tümörü kendi yarattığı boğucu ortamda ölüme terk etmeyi hedefler.
5. Anahtarların Dansı: Fosforilasyon ve Sinyal Ağları
Tüm bu karmaşık operasyon, Fosforilasyon denilen "Aç/Kapa" düğmeleriyle yönetilir.
Normalde enerji düştüğünde AMPK devreye girer ve "Büyümeyi durdur, tasarruf et" der.
Ancak kanser hücresinde bu emniyet sibobu bozulmuştur. Meme kanseri gibi türlerde, fosforilasyon kaskadları PFKFB4 ve mTOR üzerinden manipüle edilerek, enerji krizinde bile "Büyümeye Devam Et" emri verilir.
Sonuç: Geleceğin Tıbbı "Metabolik Onkoloji"
Kanser metabolizmasını anlamak, kanseri sadece genetik bir hata olarak değil, sofistike bir metabolik mühendislik hatası olarak görmemizi sağlar.
Kanser hücresi; mitokondrisini bir sinyal kulesine, sitoplazmasını bir hammadde fabrikasına ve atıklarını bir silaha dönüştürmüştür. Geleceğin tedavileri, sadece hızla bölünen hücreleri zehirlemeyi değil; onların bu kaçak enerji hatlarını kesmeyi, asidik kalkanlarını nötralize etmeyi ve onları tekrar "normal" metabolizmaya zorlamayı hedefleyecektir.
İletişim
Bize ulaşmak için aşağıdaki bilgileri kullanın.
Hİzmetler
Tıbbi Sorumluluk Reddi (Disclaimer):
Bu web sitesinde sunulan tüm içerikler yalnızca bilgilendirme amacı taşır. Sunulan bilgiler, profesyonel tıbbi tanı, tedavi ya da tavsiye yerine geçmez. Web sitesinde yer alan sağlık bilgilerinin, tıbbi karar verme sürecinizde tek başına kullanılmaması gerekir. Herhangi bir sağlık sorununuzda, şikâyetinizde ya da tedavi ihtiyacınızda mutlaka bir doktor veya ilgili uzman sağlık profesyoneline danışınız. Bu sitede yer alan bilgilerin kullanımından doğabilecek herhangi bir doğrudan ya da dolaylı zarardan dolayı site sahibi veya yazarlar sorumluluk kabul etmez.
© 2025 İlkiz Açıkalın
