"Bitkisel Kozmetik"
Oksidatif Stres: Yaşlanmanın Kök Nedeni ve Uzun Ömürlülüğün Moleküler Anahtarları
Dr. Aleksi
11/15/202510 min oku
Oksidatif Stres: Yaşlanmanın Kök Nedeni ve Uzun Ömürlülüğün Moleküler Anahtarları
Moleküler Çatışma ve Yaşlanmanın Başlangıcı
Yaşlanma, dünya çapında 900 milyondan fazla insanı etkileyen ve doku gerilemesinden birden fazla kronik hastalığa kadar uzanan karmaşık bir biyolojik süreçtir. Bu sürecin temelinde tek bir mekanizma değil, birbirini tetikleyen moleküler yolaklar yatar.
Bu yıkımın başlangıç noktası ise hücrelerimizin kaçınılmaz bir yan ürünüdür: Oksidatif Stres.
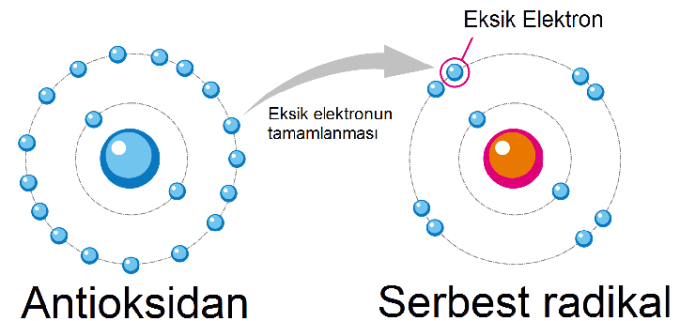
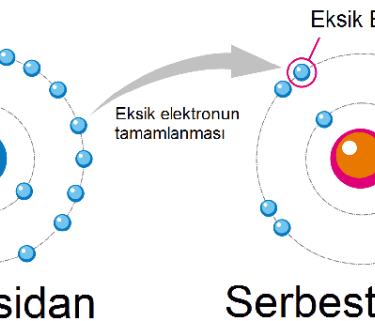
Vücudumuzdaki hücreler, enerji üretimi sırasında doğal olarak ortaya çıkan pro-oksidanlar (serbest radikaller) ile onlara karşı savaşan antioksidanlar arasında hassas bir denge sürdürür. Hücrelerimiz, enerji üretimi (aerobik metabolizma) gibi normal metabolik süreçler sırasında kaçınılmaz olarak Reaktif Oksijen Türleri (ROS) veya Serbest Radikaller üretir. Serbest radikaller, kimyasal olarak kararsız, eşleşmemiş elektronlara sahip oksijen molekülleridir. Yapılarındaki bu eksiklik nedeniyle, çevrelerindeki proteinlerden, lipitlerden veya DNA'dan elektron "çalmaya" çalışırlar.
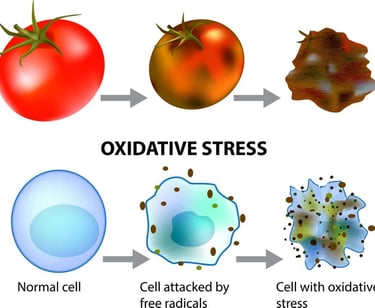
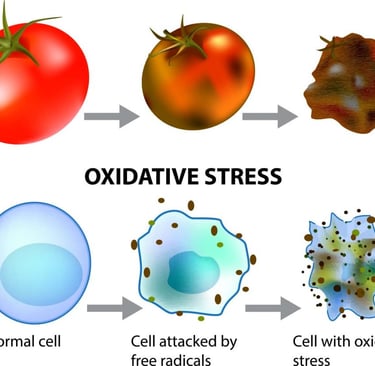
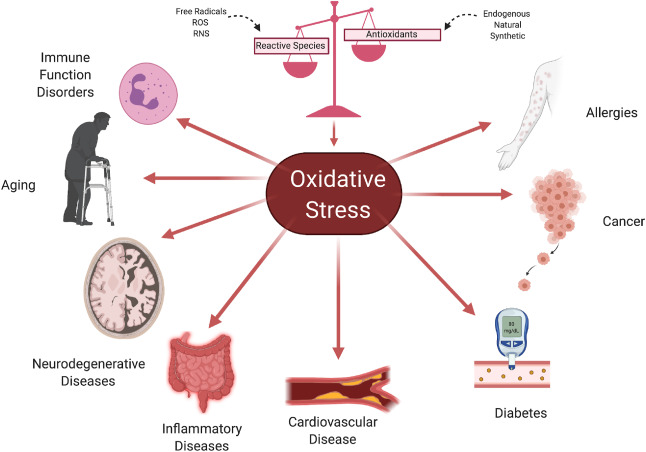
Oksidatif Stres, vücuttaki antioksidanların bu serbest radikal üretimine ayak uyduramadığı andır. Bu denge bozukluğu, serbest radikallerin vücudumuzun temel yapı taşları olan yağ dokusuna, DNA'ya ve proteinlere zarar vermeye başlamasına yol açar. Bu hasar birikimi, zamanla diyabet, hipertansiyon, kanser, Alzheimer ve Parkinson gibi çok sayıda kronik ve dejeneratif hastalığın altında yatan temel faktör olarak kabul edilir.
ROS'un İkili Rolü: Reaktif Oksijen Türleri (ROS), sadece yıkıcı değildir; bağışıklık sistemimiz yara ve enfeksiyonları iyileştirmek için geçici ve kontrollü olarak ROS üretimine ihtiyaç duyar. Ancak ROS seviyesi aşırı hale geldiğinde, genetik mutasyonlara ve kanser oluşumuna yol açar.
I. Yaşlanmanın Biyolojik Kaynakları: Düzensizliğin Kökeni
Oksidatif Stres, dünya çapında yaklaşık 900 milyon insanı etkileyen yaşlanma sürecini hızlandıran karmaşık moleküler yolakları tetikler. Yaşlanma, sadece stres değil, aynı zamanda bu stresle tetiklenen aşağıdaki çoklu mekanizmaların bir bütünüdür:
Yıkımın Başlangıcı: Serbest Radikaller ve Oksidatif Stres
Serbest Radikaller: Süperoksit anyonları, Hidrojen Peroksit ({H2O2) ve son derece reaktif olan Hidroksil radikalleri gibi eşleşmemiş elektronlara sahip oksijen içeren moleküllerdir. Bu radikaller, diğer moleküllerle reaksiyona girmeye isteklidirler.
Antioksidanlar: Hücreler tarafından üretilen ve serbest radikallere kendilerinden bir elektron vermeden elektron vererek bu yıkıcı reaksiyonlardan kaçınan moleküllerdir.
A. Bilgi Bütünlüğünün Kaybı ve Hücresel Durma
Vücut genellikle bu elektron alma-verme (serbest radikal-anti oksidan) dengesini sağlar, ancak yaşam tarzı (beslenme, egzersiz), çevresel faktörler (kirlilik, radyasyon) ve geçici iltihaplanma (bağışıklık tepkisi) bu dengeyi bozar. Serbest radikaller antioksidanlardan fazla olduğunda, yıkım başlar:
Yaşlanmanın Temel İşaretleri – Bilgi Kaybıyla ilgilidir. Yaşlanma, hücresel ve moleküler düzeylerde meydana gelen karmaşık fizyolojik değişimler bütünüdür. 2013 yılında López-Otín ve meslektaşları tarafından ortaya atılan "Yaşlanmanın Temel İşaretleri (Hallmarks of Aging)" kavramı, bu sürecin altında yatan bir dizi bağlantılı süreci tanımlar. Bu kavram, zamanla genişletilerek toplam 12 farklı süreci kapsayacak şekilde rafine edilmiştir.
Bu 12 işaret, Genomik İstikrarsızlık, Telomer Aşınması, Epigenetik Değişimler, Proteostaz Kaybı, Düzensiz Besin Algılama, Mitokondriyal Disfonksiyon, Hücresel Yaşlanma, Kök Hücre Tükenmesi, Değişen Hücreler Arası İletişim, Bağışıklık Disfonksiyonu, İnflamasyonla Yaşlanma ve Doku Dejenerasyonu'nu içerir. Hepsi, yaşlanmayı karakterize eden fizyolojik işlevdeki genel düşüşe katkıda bulunur.
İlk üç işaret; vücudun bilgi bütünlüğünün zamanla nasıl bozulduğunu gösterir: Genomik İstikrarsızlık, Telomer Aşınması ve Epigenetik Değişimler.
I. Genomik İstikrarsızlık: Kodun Bozulması
Genomik İstikrarsızlık, hücrelerde DNA hasarı ve mutasyon sıklığının artması anlamına gelir.
Nedenler: DNA'mız sürekli olarak çevresel toksinler, radyasyon ve hatta normal hücresel süreçler (DNA replikasyonu ve onarımı) gibi zararlı ajanlara maruz kalır. Zamanla bu saldırılar birikerek genetik kodda değişikliklere yol açar.
Sonuçları: DNA hasarı, hücresel stres tepkisini aktive ederek iltihaplanmaya ve senescence'e (hücre yaşlanması) yol açar. Önemli genlerdeki mutasyonlar, DNA onarımı, hücre döngüsü kontrolü ve apoptoz gibi kritik süreçleri bozarak kanser gibi yaşa bağlı hastalıkların gelişimine katkıda bulunur.
Mücadele Yolları: DNA onarım mekanizmalarını güçlendirmek (bazı ilaçlarla farelerde yaşa bağlı bilişsel gerilemenin tersine çevrilmesi gibi) ve DNA'ya zarar veren ajanlara maruziyeti azaltmaktır.
II. Telomer Aşınması: Kromozom Kapaklarının Kısalması
Telomer Aşınması, kromozomların uçlarında bulunan koruyucu başlıklardır. Telomerler, genomun stabilitesini korumada ve DNA'yı hasardan korumada kritik bir role sahiptir.
Mekanizma: Her hücre bölünmesiyle telomerler kısalır. Telomerler aşırı derecede kısaldığında, hücre ya senescence'e (kalıcı durma) ya da hücre ölümüne (apoptoz) gider.
Yaşlanma Bağlantısı: Kısalan telomerler, hücreleri DNA hasarına karşı daha savunmasız hale getirir, bu da hücresel işlev bozukluğuna yol açar. Kısa telomerler; kardiyovasküler hastalıklar, demans ve diyabet gibi bir dizi yaşa bağlı hastalıkla ilişkilendirilmiştir.
Mücadele Yolları: Telomer uzunluğunu korumaktan sorumlu enzim olan telomeraz aktivitesini artırmak ve oksidatif stres ile iltihaplanma gibi telomer kısalmasına katkıda bulunan faktörlere maruziyeti azaltmaktır. Düzenli egzersiz gibi sağlıklı yaşam tarzı alışkanlıkları telomer uzunluğunun korunmasıyla ilişkilendirilmiştir.
III. Epigenetik Değişimler: Gen İfadesinin Sessiz Değişimi
Epigenetik Değişimler, DNA dizisindeki bir değişikliğe gerek kalmadan, gen ifadesini etkileyen kimyasal modifikasyonlardır (DNA ve ilişkili proteinler, yani histonlar üzerindeki değişiklikler).
Mekanizma: Bu modifikasyonlar (örneğin DNA metilasyonundaki değişimler) hücresel süreçlerin, gelişimin ve çevresel tepkilerin düzenlenmesinde kritik rol oynar. Yaşlandıkça, bu epigenetik işaretlerdeki bozulmalar, gen ifadesinde hatalı "açma/kapama" komutlarına yol açar.
Yaşlanma Bağlantısı: DNA metilasyon paternlerindeki değişiklikler; kanser, kardiyovasküler hastalıklar ve demans dahil olmak üzere birçok yaşa bağlı hastalıkla ilişkilendirilmiştir. Bu değişiklikler, kök hücre fonksiyonu gibi doku homeostazisini sürdürmek için gerekli olan temel hücresel süreçlerin kaybına katkıda bulunabilir.
Mücadele Yolları: Histon deasetilazlar gibi epigenetik işaretleri değiştiren enzimlerin aktivitesini artırmak ve çevresel toksinler ile strese maruziyeti azaltmaktır. Meyve ve sebzeler açısından zengin diyetler, epigenetik işaretleri olumlu yönde etkileyerek sağlıklı yaşlanmayı destekleyebilir.
IV. Özetlersek:
. Hücresel Hasar: Radikaller, öncelikle DNA'ya, yağ dokusuna (lipitlere), proteinlere ve hücre zarlarına saldırır. Lipit Peroksidasyonu: Peroksinitrit ve hidroksil radikallerinin fazlalığı, lipoproteinlere ve hücre zarlarına zarar vererek lipit peroksidasyonuna neden olur. Bu durum, mutajenik ve sitotoksik olan konjuge dien ve malondialdehit gibi bileşiklerin üretimine yol açar
. DNA Hasarı: Oksidatif stres, DNA ile reaksiyona girerek DNA hasarı tepkimesini tetikler ve telomer kısalmasını hızlandırır. Oksidatif stres, kromozomların uçlarını koruyan Telomerlerin yıpranmasına neden olur. Kısalan telomerler, hücre bölünme döngüsünü durdurur ve hücre yaşlanmasını tetikler.
. Genetik Kontrol (Sirtuinler ve Klotho): Sirtuinler (NAD+ bağımlı enzimler), stres direncini artırırken, Klotho geni ekspresyonunun yaşla azalması ve p53/p21 gibi proteinlerin aktivasyonu, hücre yaşlanmasını hızlandırır.
. Hastalık Zeminine Hazırlık: Bu hücresel hasar, yaşamın ilerleyen dönemlerinde şu hastalıkların kapısını aralar: Kalp hastalığı, Yüksek tansiyon, Kanser, Ateroskleroz, Diyabet, Alzheimer ve diğer nörodejeneratif ve kronik inflamatuar hastalıklar
Yaşlanmanın 12 işareti, birbirini etkileyen biyolojik süreçlerden oluşan geniş ve sıkı bir ağdır. Genomik instabilite, telomer aşınması ve epigenetik değişimler gibi bu temel işaretlere odaklanmak ve onları hedef alan stratejiler geliştirmek, sağlıklı yaşlanmayı desteklemek ve insan sağlığı süresini uzatmak için hayati öneme sahiptir.
Yaşlanmanın Temel Moleküler Mekanizmaları
Oksidatif stres tek başına yaşlanmayı açıklamaz. Yarattığı hasar, hücrenin doğal savunma mekanizmalarını tetikler; ancak bu mekanizmalar kronikleştiğinde, yaşlanmayı hızlandıran Antagonistik Özelliklere dönüşür.
Vücudun savunma mekanizmaları kronikleşerek bizzat yaşlanmaya neden olur:
A. Hücresel Savunmanın İkilemi (Antagonistik Özellikler)
Hücresel Yaşlanma (Senescence): "Zombi Hücrelerin" Birikimi
Mekanizma: DNA hasarı, Oksidatif Stres ve telomer kısalması ile tetiklenen hücreler, bölünmeyi durdurur ancak ölmezler.
Yıkıcı Etki: Bu "Zombi Hücreler," çevrelerindeki sağlıklı hücrelerin yaşlanmasını tetikleyen ve kronik iltihaplanmayı başlatan Senescence İlişkili Salgı Fenotipini (SASP) salgılar (İnflamatuar sitokinler). DNA, protein ve lipit hasarı $\rightarrow$ p38MAPK aktivasyonu $\rightarrow$ p16 upregülasyonu $\rightarrow$ Hücre Yaşlanması döngüsü başlar.
Devre Dışı Bırakılmış Otofaji: Bozulmuş Hücresel Geri Dönüşüm
Mekanizma: Otofaji (kendi kendini yeme), hücrenin hasarlı Mitokondriler ve toksik proteinler gibi kusurlu bileşenleri temizleyen hayati geri dönüşüm sürecidir. Yaşlanmayla bu süreç yavaşlar veya devre dışı kalır.
Sonuç: Hücre içi atık birikimi, oksidatif stresi artırır ve metabolik ile nörodejeneratif hastalık (örneğin Alzheimer plakları) riskini yükseltir.
Düzensiz Besin Algılama: Sürekli Büyüme Sinyali
Temel Yolaklar: Hücre, büyümeyi ve enerji dengesini mTOR (büyümeyi destekler) ve AMPK (enerji tasarrufunu teşvik eder) yolları üzerinden yönetir.
Yaşlanma Etkisi: Yaşla ve aşırı beslenmeyle birlikte mTOR yolu sürekli aktif kalma eğilimi gösterir. Sürekli büyüme sinyali, insülin direncine, metabolik bozukluklara ve obezite/diyabet riskine yol açar. Uzun ömürlülük, bu yolakların dengeli ve genellikle düşük aktivitede kalmasına bağlıdır.
B. Diğer Hücresel ve Moleküler Mekanizmalar
AMPK Yolu: Hücresel enerji metabolizmasını düzenler. SIRT1'i aktive ederek ve mTOR'u düzenleyerek yaşlanma sürecine müdahale eder.
Sirtuinler ve Klotho: Sirtuinler (NAD+ bağımlı deasetilazlar), özellikle SIRT1 (uzun ömür geni), FOXO proteinlerini deasetilleyerek hücrenin stres direncini artırır. Klotho geni ekspresyonunun yaşla azalması ise yaşlanmayı hızlandırır ve SIRT1'i baskılar.
NF-kappa B Yolu: Bu transkripsiyon faktörü, iltihaplanma (inflamasyon), oksidatif stres ve apoptozda rol oynar. Yaşlanmayla ilişkili inflamatuar faktörler tarafından aktive edilir ve nörodejeneratif hastalıklarda artmış aktivite gösterir.
Nrf2 Yolu: Oksidatif stres altında çekirdeğe girerek antioksidan proteinlerin ve detoksifikasyon enzimlerinin ifadesini artıran önemli bir antioksidan düzenleyicisidir. Yaşla birlikte azalması, Oksidatif Stresi artırır.
Oksidatif Stres Yönetimi ve Tedavi Yaklaşımları
Serbest radikallere maruz kalmaktan tamamen kaçınmak imkansızdır, ancak oksidatif stresin etkilerini azaltmak mümkündür.
A. Yaşam Tarzı ve Beslenme Stratejileri
Antioksidan Zengin Beslenme: Tam gıdalardan (Meyve, sebze, balık, kuruyemişler) alınan E ve C vitaminleri, zerdeçal, yeşil çay gibi antioksidanlar, kan antioksidan seviyelerini artırır. Antioksidan takviyelerinin tam gıdalarla kıyaslandığında faydası olmadığı, hatta zarar verebileceği gösterilmiştir.
Serbest Radikal Kaynaklarını Azaltma: Sigara, alkol, pestisitler ve hava kirliliği gibi toksik kimyasallara maruziyet azaltılmalıdır.
Egzersiz ve Uyku: Orta düzeyde egzersiz, vücudun doğal antioksidan seviyelerini yükseltir. Bol uyku ve daha az alkol tüketimi de kritik öneme sahiptir.
B. .Mücadele ve Uzun Ömür Stratejileri
Oksidatif stres ve yaşlanma mekanizmaları kaçınılmaz olsa da, Fonksiyonel Tıp ve Longevity biliminin amacı onları yok etmek değil, yeniden dengelemektir.
1. Beslenme ve Yaşam Tarzı ile Yönetim
Oksidatif stresle mücadele etmenin ve genç kalmanın en güçlü yolu, dışarıdan antioksidan alımını artırmak ve serbest radikal üretimini azaltmaktır:
Antioksidan Açısından Zengin Besinler: Bol miktarda meyve ve sebze tüketimi kritik öneme sahiptir. Özellikle Bitter Çikolata (yüksek kakao), Pekan Cevizi, Yaban Mersini/Kırmızı Meyveler, Enginar, Chia Tohumu ve Kara Lahana gibi koyu yeşil sebzeler antioksidan seviyelerini yükseltir.
Egzersiz: Düzenli fiziksel aktivite, antioksidan seviyelerini artırarak ve metabolik işlevi optimize ederek yaşlanma sürecini yönetmeye yardımcı olur.
2. Moleküler Optimizasyon (Antagonistik Özelliklerle Mücadele)
Otofaji Geliştirme: Hücresel geri dönüşümü aktive etmek için Aralıklı Oruç (Fasting), Kalori Kısıtlaması veya Spermidin gibi besinlerin kullanımı teşvik edilir.
Senolitikler: Yaşlanan "Zombi hücrelerin" biyokimyasal olarak temizlenmesine yardımcı olan Quercetin veya Fisetin gibi bileşikler kullanılabilir.
Metabolik Optimizasyon: Daha iyi enerji dengesi ve uzun ömürlülük için AMPK'yı aktive ederek (Metformin, Berberin) veya SIRT1'i aktive ederek (Resveratrol) sürekli büyüme sinyali veren mTOR ve IGF-1 sinyalini hassas bir şekilde düzenlemek hedeflenir.
Bitkisel İlaçlarla Moleküler Müdahale
Bitkisel ilaçlar (fitoterapi), yaşlanmanın çoklu mekanizmalarını eş zamanlı hedef alır:
Ginkgo Biloba & Ginseng: Telomeraz aktivasyonu, PI3K/Akt ve Akt/mTOR sinyal yollarını modüle ederek nöral hücre yaşlanmasını ve vasküler yaşlanmayı engeller.
Astragalus & Kurkumin: Antioksidasyon ve mitokondriyal koruma sağlarken, NF-$\kappa$B gibi iltihap yollarını baskılayarak sistemik iltihaplanmayı azaltır.
Resveratrol: SIRT1 ve Nrf2 aktivasyonu, otofajiyi düzenleyerek genetik ve oksidatif hasarla mücadele eder.
Sonuç: Oksidatif stres, vücudun yağ dokusuna, DNA'ya ve proteinlere zarar vererek hücresel yaşlanmayı ve kronik hastalıkları tetikleyen kritik bir dengesizliktir. Bu durumla mücadele, sadece antioksidan almakla kalmaz, aynı zamanda Telomer hasarı, mTOR aktivitesi ve hücresel temizlik (Otofaji) gibi çoklu moleküler yolakların dengelenmesini gerektirir.
Oksidatif Stresin Analizi: Oksidatif hasarın başlıca göstergesi olan lipit peroksidasyonunun taranması ve izlenmesi için TBARS (Tiyobarbitürik Asit Reaktif Maddeler) testi tercih edilen yöntemdir.
Analiz Yöntemleri
Oksidatif stresin seviyesi ve lipit peroksidasyonunun taranması için TBARS (Tiyobarbitürik Asit Reaktif Maddeler) testi sıklıkla tercih edilir. Oksidatif hasara maruz kalmaktan tamamen kaçınmak imkansız olsa da, bilimsel analizler ve kişiselleştirilmiş müdahalelerle yönetilebilir ve yaşam beklentisi artırılabilir.
Sonuç: Yaşlanma, Oksidatif Stres'in başlattığı, hücresel savunma mekanizmalarının kronikleştiği (Senescence, Otofaji Bozukluğu) ve temel besin algılama yollarının (mTOR) düzensizleştiği çok hedefli bir yıkımdır. Uzun ömürlü ve sağlıklı bir yaşam sürmek için, bu karmaşık moleküler yolakları bütünsel bir yaklaşımla anlamak ve dengelemek zorunludur.
İletişim
Bize ulaşmak için aşağıdaki bilgileri kullanın.
Hİzmetler
Tıbbi Sorumluluk Reddi (Disclaimer):
Bu web sitesinde sunulan tüm içerikler yalnızca bilgilendirme amacı taşır. Sunulan bilgiler, profesyonel tıbbi tanı, tedavi ya da tavsiye yerine geçmez. Web sitesinde yer alan sağlık bilgilerinin, tıbbi karar verme sürecinizde tek başına kullanılmaması gerekir. Herhangi bir sağlık sorununuzda, şikâyetinizde ya da tedavi ihtiyacınızda mutlaka bir doktor veya ilgili uzman sağlık profesyoneline danışınız. Bu sitede yer alan bilgilerin kullanımından doğabilecek herhangi bir doğrudan ya da dolaylı zarardan dolayı site sahibi veya yazarlar sorumluluk kabul etmez.
© 2025 İlkiz Açıkalın
