"Bitkisel Kozmetik"
Onkoloji-Yoğun Bakım-İnfeksiyon hastalıkları Kliniklerinin İlgilendiği bir hasta için Tıbbi Analiz:
Dr. Aleksi
12/9/202516 min oku
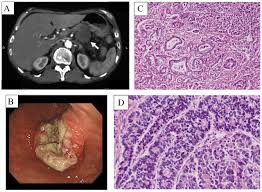
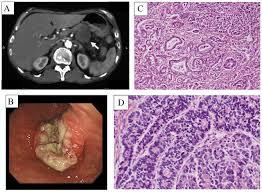
60 yaş civarında erkek hasta, Son 3-4 ay içinde Pankreas kanseri (Evre:2), tanısı konmuş, Whipple ameliyatı ve Whipple ameliyatı sonrasında gelişen sepsis ve postop. kanama (DIC) kontrolü için yapılan 2 cerrahi girişim olmak üzere 3 ameliyat geçirmiş, son 3 aydan beri yoğun bakım koşulları öyküsü var. Yoğun Bakımda muhtemel DIC (Dissemine IntraVasculer Koagulation) ve sepsis gelişen, bu koşullar altındayken Kalp Masajı ve adrenalin ile tekrar yaşama döndürülen kardiak arrest (kalp durması) ve sonrası 3 gün entübasyon yapılmış olan hasta için, kemoterapi, ve hastane ortamı koşullarında direnç geliştirmiş olan bakterilere bağlı sepsis (septisemi) için inflamasyon ve infeksiyonu iyileştirmeyen antibiyotiklerle tedavi devam edilmeli mi?
Bu durumda bütüncül tıp modern tıbbın üstesinden gelemediği bu karmaşık riskli onkoloji + yoğun bakım koşullarında takip edilen, durumu kritik ve acil olan hasta için başka ne yapılabilir?
Bu riskli durumu en ince ayrıntısına kadar tartışmak bir doktorlar kurulunun işi. Ancak böyle bir kritik vakayı bir tıp dosyası halinde analiz edersek, pankreas adenokarsinomunun dirençli özgün mekanizmalarına karşı (sahte dost sinyali, fibroz doku zırhı (korunma kalkanı) immün sistemi olumsuz etkileyen yanlış yanıltıcı kanser hücresi sinyallerini etkisiz hale getirecek bitkisel metabolitlerle etkili bir tedavi programı olabilir mi? Modern Tıbba Asya Tıbbının yaklaşımlarıyla bir katkı sunulabilir mi? Hastanın yaşamı Modern Tıp yöntemlerine rağmen ciddi anlamda tehdit altında olduğu için Evet.
Hastamızın durumu, modern tıbbın ve onkolojinin sınırlarını zorlayan, çok katmanlı, yüksek mortalite riski taşıyan bir "tıbbi savaş" senaryosudur: Multidirençli Sepsis Zemininde, Evre II Pankreas Kanseri ve Tekrarlayan DIC Öyküsü.
Standart tedavilerin (Antibiyotikler/Kemoterapi) yetersiz kaldığı bu noktada, akılcı yaklaşım, hastalığın Kök Nedenlerine ve Pankreas kanseri’nin Eşsiz Direnç Mekanizmalarına saldıran, aynı zamanda Hayatî Destek Sistemlerini koruyan Bütüncül-Metabolik bir Protokol tasarlamaktır.
İşte bu kritik durumu analiz eden ve çözüm önerileri sunan, akademik temelli, vaka dosyası formatında bir tartışma:
KRİTİK VAKA DOSYASI: Pankreas Kanseri (PAC), SEPSİS VE METABOLİK İNTİKAM
Hasta Profili: 60 Yaş Civarı, Evre II Pankreas Adenokarsinomu (PAC)
Kritik Öykü: 3 Cerrahi Girişim (Whipple + Revizyonlar), 3 Ay Yoğun Bakım, Kardiyak Arrest (Adrenalinle Dönüş), Postop. DIC Öyküsü.
Mevcut Durum: Multidirençli Bakteriyel Sepsis, Lökositoz (++), Yüksek CRP (+++), Genel İmmün Yetersizlik.
BÖLÜM I: TIBBİ SİSTEMİN ÇÖKÜŞ NOKTASI
1. Antibiyotik Kullanımı ve Kritik Soru
Soru: Enflamasyonu ve enfeksiyonu iyileştirmeyen antibiyotiklere devam edilmeli mi?
Analiz: Bu durumda antibiyotiklere körü körüne devam etmek bir hata olabilir. Yüksek lökositoz ve CRP'ye rağmen enfeksiyonun gerilememesi, bakteriyel direncin yanı sıra İmmünolojik İflas ve Mantar (Fungal) veya Viral (EBV/CMV) koinfeksiyon ihtimalini işaret eder. Antibiyotiklerin devamı, hastanın zaten çökmüş olan Bağırsak Mikrobiyotasını daha da tahrip ederek yeni dirençli patojenlere ve besin emilim sorunlarına yol açar.
Akılcı Çözüm: Antibiyotikler dar spektrumlu, hedef odaklı (kültüre göre) dozlara düşürülmeli veya antibiyotik dışı, hücre içi patojenleri hedef alan destekler (Örn: Oleuropein) hızla entegre edilmelidir.
KANSERİN MİMARLARI: Pankreas Kanserindeki Direnç Mimarisi ve Çoklu Hücre Savaşı
Pankreas Adenokarsinomu (PAC), modern onkolojinin en ölümcül ve dirençli kanser türlerinden biridir. Bu kanserin düşük yaşam süresinin (%9) ana nedeni, tümör hücresinin kendisinden ziyade, onu çevreleyen ve koruyan karmaşık savunma sistemidir. Bu sistemin merkezinde ise Kanser İlişkili Fibroblastlar (CAFs) bulunur.
Pankreas kanseri, hayatta kalmak için üç temel direnç mekanizması geliştirir. Terapötik başarı, bu üç mekanizmayı aynı anda hedefleyen stratejilere bağlıdır.
I. PANKREAS KANSERİ’NİN ÜÇLÜ DİRENÇ MEKANİZMASI
A. Birinci Savunma Hattı: Fibrotik Zırh (Stroma)
Pankreas kanseri, çevresinde aşırı yoğun ve sert bir bağ dokusu (stroma) biriktirir; bu duruma desmoplastik reaksiyon denir.
Zırhın Bileşenleri: Bu sert siperin ana hücreleri CAFs'lerdir. CAFs'ler, Kollajen ve Hiyalüronik Asit (HA) gibi Hücre Dışı Matriks (ECM) proteinlerini aşırı üreterek tümör etrafında fiziksel bir bariyer oluşturur.
Direnç Etkisi: Bu "Fibrotik Kalkan", damarları sıkıştırır, ilaçların (kemoterapi) tümör merkezine ulaşmasını engeller (penetrasyonu azaltır) ve radyoterapiye karşı direnci artırır. Bu sert matris aynı zamanda tümörün agresifliğini destekler.
Çözüm: Kalkanı Yıkmak (Stroma Yıkımı)— İlaçların tümöre geçişini sağlamak ve kanser hücresini siperinden çıkarmak.
B. İkinci Savunma Hattı: Sahte Dost Sinyali (İmmün Yanıltma)
CAFs, tümör mikroçevresindeki (TME) bağışıklık sistemini kanserin lehine çeviren ana orkestra şefidir.
Direnç Yaratma: CAFs, salgıladığı kimyasallar (Örn: CXCL12, IL-6) ile immün hücreleri (özellikle T-Regs, MDSCs) tümör bölgesine çeker ve bu hücreleri Tümör Destekleyici Makrofajlara (TAM) dönüştürür.
Katil Hücreleri Engelleme: CAFs, kanseri öldüren CD8+ T hücrelerinin tümöre sızmasını fiziksel olarak engeller ve işlevlerini bloke eden sinyaller (Örn: PD-1/CTLA-4 gibi Kontrol Noktası belirteçlerinin artırılması) salgılar.
Çözüm: Dostu Kurtarmak (İmmün Modülasyon)— Yanıltıcı sinyalleri kesmek ve bağışıklık sisteminin doğru hedefi görmesini sağlamak.
C. Üçüncü Savunma Hattı: Metabolik Esneklik (Hücresel Yakıt Takası)
Pankreas kanseri, besin ve oksijenin kıt olduğu bu sert kalkanın içinde hayatta kalmak zorundadır. Burada şaşırtıcı bir metabolik takas gerçekleşir:
Reverse Warburg Effect (Tersine Savaş Etkisi): pankreas kanseri, komşu CAFs'leri aerobik glikolize (oksijen varlığında bile glikozu hızlıca yakma) zorlar.
Geri Alım (Beslenme): CAFs, bu süreçte ürettiği Laktat ve Piruvat gibi enerji açısından zengin metabolitleri kanser hücrelerine geri verir. Kanser hücresi, bu 'hazır yakıtı' alarak kendi enerji santralinde (OXPHOS) kullanır ve yoğun glikoz/glutamin bağımlılığını sürdürür.
Çözüm: Aç Bırakmak (Metabolik Reprogramlama)— Kanser hücresinin enerji kaynaklarını kesmek ve onu kemoterapiye karşı savunmasız bırakmak.
II. CAFs’İN ÇOK YÜZLÜ KİMLİĞİ VE TEDAVİ İKİLEMİ
CAFs, tek tip hücreler değildir (heterojenite). Onları anlamak, tedavideki zorluğun anahtarıdır.
1. Kökenler ve Aktivasyon
CAFs'lerin ana kaynakları arasında normalde A vitamini depolayan Pankreatik Yıldız Hücreleri (PSCs) bulunur. PSC'ler, tümörden gelen sinyaller (TGF-beta, IL-6 gibi sitokinler) ile aktive olur ve fibrotik kalkanı örmeye başlar. Ancak CAFs'ler, yağ hücreleri (adipositler) ve bağışıklık hücreleri (makrofajlar) dahil olmak üzere farklı hücrelerden de dönüşebilmektedir.
2. Alt Tipler ve Paradoks
CAFs'lerin iki ana alt tipi vardır: myCAFs (Miyofibroblastik, tümöre yakın, fibrozis artırıcı) ve iCAFs (İnflamatuar, tümörden uzak, sitokin salgılayıcı). Ancak klinik çalışmalar bir paradoks ortaya çıkarmıştır:
Tedavi İkilemi: MyCAFs'leri tamamen yok eden tedaviler, bazen tümörü daha agresif hale getirmiş ve yaşam süresini kısaltmıştır. Bu durum, CAFs'lerin bazı alt tiplerinin tümör büyümesini aslında yavaşlatıcı bir rol de üstlenebileceği anlamına gelir. Bu belirsizlik, CAF'leri hedef alan tedavileri son derece karmaşık hale getirir.
III. AKILCI TEDAVİ HEDEFLERİ (Bench-to-Bedside)
Klinik çalışmalar, fibrozisi tek başına yıkmanın veya CAFs'leri tamamen yok etmenin yetersiz kaldığını göstermiştir. Akılcı strateji, CAFs'leri öldürmek yerine onları normalleştirmek ve metabolik yollarını kesmektir.
1. Kalkanı Yok Etme ve Normalleştirme Stratejileri
Kalkanı Çözme: Tümör matrisinin ana bileşeni olan HA'yı parçalayan enzimler (PEGPH20) veya Kollajen sentezini inhibe eden ajanlar denenmiştir, ancak başarısızlıklar yaşanmıştır.
CAFs'i Uysallaştırma (Normalizasyon): CAFs'leri öldürmek yerine onları normal, uysal fibroblast durumuna döndürmek hedeflenir. Örneğin, PSC'lerin inaktif hale geçmesini sağlayan Retinol (A vitamini) restorasyonu ile normalleşme protokolleri araştırılmaktadır.
Sinyal Kesme: CAFs aktivasyonunu tetikleyen sinyalleri (TGF-$\beta$, CXCL12-CXCR4) bloke eden ilaçlar araştırılmaktadır.
2. Geleceğin Anahtarı: Metabolik Bağlantıyı Kesmek
Makalenin ana sonucu, gelecekteki tedavilerin, CAFs'lerin kanser hücresine sunduğu metabolik desteği kesmeye odaklanması gerektiğidir:
Aç Bırakma: CAFs'in yoğun glikoliz yoluyla ürettiği ve kanser hücresine besin olarak sunduğu Laktat ve Glutamin akışını kesen ajanlar, kanseri beslenme kaynağından yoksun bırakır.
İmmün/Metabolik Modülasyon: Hücre metabolizması ile immün fonksiyon arasındaki bağlantıyı hedefleyen yeni metabolik ajanlar (Örn: MetG1 gibi yeni alt tipleri hedefleyen bileşikler), kanseri hem aç bırakan hem de bağışıklık sistemini uyandıran potansiyel çözümler sunmaktadır.
BÖLÜM II: AKILCI YAKLAŞIM PROTOKOLÜ (Acil Destek + Onkolitik Etki)
Bu protokol, DIC riskini artırmadan, sepsisin enflamatuar yükünü azaltmaya, tümör direncini kırmaya ve immün sistemi uyandırmaya odaklanır.
A. KRİTİK DURUM YÖNETİMİ: ENFLAMASYON VE DAMAR KORUMASI
Bu aşamada öncelik, DIC'i yeniden tetikleyebilecek olan Sistemik Enflamasyonu (CRP) ve Endotel Hasarını sıfırlamaktır.
Lipozomal Kurkumin: NF-kappaB Kapatıcısı: Enflamatuar genlerin ana anahtarını inhibe eder. Sepsiste yükselen IL-6 ve TNF-alpha sitokinlerini hızla baskılar. Enflamasyonu keserek DIC riskini ve pankreas kanseri'nin enflamasyonla beslenme döngüsünü durdurur.
Boswellia Serrata: Lökotrien Kesici (5-LOX): Enflamatuar sinyalleri farklı bir yoldan keserek Kurkumin ile sinerji yaratır.
C Vitamini (Yüksek Doz IV): Endotel Onarımı: Yoğun bakım koşullarında hızla tükenen C Vitamini, damar duvarı (kollajen) onarımı için zorunludur. Endotel Hasarını onararak DIC'i önlemede kritik destek sağlar.
Quercetin: Mast Hücresi Stabilizasyonu: Akut enflamasyon döngüsünü yavaşlatır ve damar duvarı geçirgenliğini azaltarak stabilite sağlar.
B. ONKOLİTİK SALDIRI: DİRENÇ MEKANİZMALARINI İPTAL ETME
1. Fibrotik Zırhı Kırma (Hedef I)
EGCG (Yeşil Çay Kateşinleri): Anti-Fibrotik etkisi ile pankreas kanseri'nin yoğun Kollajen ve HA sentezini inhibe eder. Bu, tümör zırhını yumuşatarak diğer ajanların penetrasyonunu sağlar.
Genistein (İzoflavon): HA ve kollajen matriksini modüle ederek pankreas kanseri'nin koruyucu yapısını zayıflatır.
Quercetin: Doğrudan bir proteolitik enzim (Bromelain gibi) olmamasına rağmen, fibrotik zırhı parçalayan veya oluşumunu engelleyen en etkili dolaylı metabolitlerden biridir.
Özellikle Pankreas Adenokarsinomu (PAC) gibi, bağ dokusundan (stroma) oluşan yoğun bir fibrotik kalkan geliştiren tümörlere karşı Quercetin'in rolü, sadece anti-enflamatuar olmaktan çok daha önemlidir.
Quercetin'in Fibrotik Zırhı Parçalama Mekanizması
Quercetin, bir flavonoid olarak, PAC'nin etrafındaki sert stroma yapısını (Kollajen ve Hiyalüronik Asit) oluşturan ve koruyan hücreleri ve sinyal yollarını hedef alır.
. Fibrozis Oluşumunu Engellemek (Anti-Fibrotik Etki): Fibrozis (skar dokusu oluşumu) sürecinin ana mimarları Myofibroblastlar ve Pankreatik Yıldız Hücreleri (Pancreatic Stellate Cells - PSC)'dir. PSC'ler, PAC'de yoğun Kollajen ve Hiyalüronik Asit (HA) üreterek o sert kalkanı oluşturur.
Sinyal Kesici: Quercetin, PSC'lerin aktivasyonunu ve çoğalmasını tetikleyen temel büyüme faktörlerini (Örn: TGF-$\beta$) baskılar. TGF-$\beta$'nın baskılanması, yeni fibroz doku üretimini yavaşlatır.
Kanıt: Deneysel çalışmalarda Quercetin'in PSC'lerin aktivitesini doza bağımlı olarak inhibe ettiği ve böylece fibrotik matriks birikimini azalttığı gösterilmiştir.
Metalloproteinazların Düzenlenmesi (Matriks Yıkımı): Fibrotik zırhın yıkılması ve yeniden şekillenmesi, Matriks Metalloproteinazlar (MMP'ler) ve onların inhibitörleri (TIMP'ler) arasındaki hassas dengeye bağlıdır.
MMP'ler: Bunlar, bağ dokusunu parçalayan enzimlerdir. Kanser hücreleri bu enzimleri kendi işlerine geldiği gibi kullanır.
Quercetin'in Rolü: Quercetin, MMP'lerin dengesini düzenleyerek tümör matrisinin patolojik sertliğini azaltmaya yardımcı olabilir. Aynı zamanda, stroma yıkımı için gereken bazı enzimatik aktiviteyi de dolaylı olarak destekleyebilir.
Endotel ve Enflamasyon Yoluyla Dolaylı Yıkım: Quercetin, sadece fibrozise değil, aynı zamanda o bölgedeki enflamasyon ve damar yapısına da etki ederek dolaylı bir yıkım sağlar.
Enflamasyon Kontrolü: Quercetin, güçlü bir NF-$\kappa$B inhibitörü ve Mast Hücresi Stabilizatörüdür. Kronik enflamasyonu azaltarak, fibrozisi tetikleyen ortamı (pro-enflamatuar sitokinler) ortadan kaldırır. Enflamasyon azalınca fibrozis uyarımı da düşer.
EGCG ve Genistein ile Sinerji: Quercetin'i, bir önceki protokolde bahsettiğimiz EGCG ve Genistein gibi diğer anti-fibrotik ajanlarla birlikte kullanmak, PAC'nin fibrotik zırhına karşı çok boyutlu ve sinerjik bir saldırı anlamına gelir:
EGCG ve Genistein: Fibrozis oluşumunu engeller ve HA/Kollajen sentezini baskılar (Üretimi durdurur).
Quercetin: Fibrozisi tetikleyen temel sinyal yollarını (TGF-$\beta$) ve enflamatuar ortamı (NF-$\kappa$B) iptal eder (Sinyali keser). Bu üçlünün kombinasyonu, PAC'nin bağışıklık ve kemoterapi direncinin temelini oluşturan o sert siperi ortadan kaldırmakta kritik öneme sahiptir.
2. İmmün Yanıltmayı Düzeltme (Hedef II)
Artemisinin (veya Artemether): Kanser hücrelerinin yüksek demir alımına dayanan (Ferroptozis) hedefli toksisite sağlar. Aynı zamanda sepsiste yükselen sitokinleri ve immün yanıltma sinyallerini baskılar. DIC riski açısından güvenli kabul edilir.
Ekinezya: İmmün sistemi genel olarak uyandırmak yerine, makrofajların fagositik (yutucu) kapasitesini artırarak, pankreas kanseri'nin TAM'lara (Tümör Destekleyici Makrofaj) dönüşme sürecini yavaşlatmaya yardım eder.
3. Metabolik Açlık Yaratma (Hedef III)
Berberin: AMPK Aktivasyonu yoluyla kanser hücresini glikoz ve glutamin bağımlılığından ayırır. Hücrenin enerji tüketimini artırırken (Hücresel Savaş), enerji kaynağını keserek kemoterapiye karşı duyarlılığını artırır.
R-Alfa Lipoik Asit (R-ALA): Mitokondriyal kofaktör olarak, kanser hücresinin bozuk mitokondrisinde ROS üretimini artırarak hücreyi intihara zorlar.
BÖLÜM III: AKILCI YAKLAŞIM PROGRAMI
Doktorlar ekibini ikna edecek bu akılcı yaklaşım, hastanın kritik metabolik durumunu merkezine alır:
Hızla Enflamasyonu Kes: İlk 48 saatte yüksek doz Lipozomal Kurkumin ve C Vitamini (IV formunda) ile akut sitokin fırtınası durdurulmalıdır. (DIC riskini düşürmenin tek yolu budur).
Yanıltıcı Sinyalleri İptal Et: Artemisinin (Antisepsis ve Anti-Kanser olarak) ve Berberin (Metabolik açıdan) hemen başlanmalıdır. Bu ikili, hastanın direncini kırmada temel rol oynar.
Kalkanı Parçala: EGCG ve Genistein, tümörün fibrotik zırhını yumuşatmaya başlar.
Antibiyotik Yönetimi: Kültür sonuçlarına göre antibiyotikler dar spektruma çevrilmeli, eş zamanlı olarak Zeytin Yaprağı Ekstraktı gibi direnç kırma potansiyeli olan ajanlarla desteklenmelidir.
Bu hasta için modern tıbbın sadece "devam et" demesi yeterli değildir. Bütüncül Tıp, burada bir "ek" değil, hayati fonksiyonları stabilize eden ve kanserin benzersiz savunma mekanizmalarını hedefleyen entegre bir kritik destek protokolü sunmaktadır.
Klinik araştırmalardan öne çıkan bulgular
Kurkumin
Deneysel sepsis modellerinde NF‑κB ve IL‑6/TNF‑α baskılamasıyla inflamatuvar yanıtı azalttığı gösterildi.
İnsan çalışmalarında güvenlik profili genellikle iyi, fakat yüksek dozlarda antikoagülan etki riski var.
Küçük ölçekli klinik denemelerde CRP ve IL‑6 düzeylerinde anlamlı azalma raporlandı.
Bazı kanser hastalarında yaşam kalitesi skorlarında iyileşme ve yorgunlukta azalma bildirildi.
Sepsis modellerinde inflamatuvar yanıtın baskılanmasıyla organ fonksiyon skorlarında iyileşme gözlendi.
Resveratrol
SIRT1 aktivasyonu üzerinden endotelyal fonksiyon ve mikrosirkülasyon desteği sağladığı bildirildi.
Küçük klinik serilerde inflamatuvar belirteçlerde azalma gözlendi; kanama riski nedeniyle dikkatli kullanılmalı.
Klinik serilerde endotelyal fonksiyonun iyileştiği, nitrik oksit üretiminin arttığı ve mikrosirkülasyonun desteklendiği raporlandı.
İnflamatuvar sitokinlerde (TNF‑α, IL‑1β) azalma gözlendi.
Kanser hastalarında oksidatif stres belirteçlerinde düşüş bildirildi.
Epigallokateşin gallat (EGCG)
Yeşil çay polifenolü; antioksidan ve immün modülatör etkiler.
Deneysel sepsis modellerinde organ hasarını sınırladığı raporlandı.
Küçük klinik çalışmalarda oksidatif stres belirteçlerinde azalma ve immün hücre fonksiyonlarında düzenlenme raporlandı.
Bazı kanser hastalarında tümör ilişkili inflamatuvar yanıtın baskılanması gözlendi.
Beta‑glukanlar
Mantar kaynaklı polisakkaritler; makrofaj ve nötrofil fonksiyonlarını düzenler.
Bazı klinik çalışmalarda enfeksiyon sıklığını azalttığı bildirildi.
Kanser hastalarında yapılan çalışmalarda enfeksiyon sıklığında azalma ve immün hücre aktivitesinde artış bildirildi.
Kritik bakım hastalarında bağışıklık yanıtının güçlendiği gözlendi.
Quercetin
Anti‑inflamatuvar ve antioksidan; endotoksin kaynaklı inflamatuvar yanıtı baskılayabilir.
İnsanlarda güvenlik profili genellikle iyi, fakat biyoyararlanım sınırlı.
Klinik denemelerde inflamatuvar belirteçlerde azalma ve antioksidan kapasitede artış raporlandı.
Biyoyararlanım düşük olduğu için sonuçlar heterojen; liposomal formülasyonlarda daha belirgin etkiler görüldü.
Omega‑3 yağ asitleri
EPA/DHA, pro‑inflamatuvar eikosanoidlerin yerine resolvin/protectin üretimini artırır.
Kritik hastalarda inflamasyon ve immün yanıt regülasyonunda destekleyici rolü incelenmiştir.
Kritik bakım hastalarında CRP ve IL‑6 düzeylerinde düşüş, organ fonksiyon skorlarında iyileşme raporlandı.
Kanser hastalarında yaşam kalitesi skorlarında artış ve enfeksiyon sıklığında azalma bildirildi.
Güvenlik ve klinik bağlam
Kanser hastalarında bitkisel ilaç güvenliği: Lancet Onkoloji’de yayımlanan bir inceleme, bitkisel ürünlerin ilaç etkileşimleri ve toksisite riskleri nedeniyle dikkatle değerlendirilmesi gerektiğini vurguluyor.
Sepsis için bitkisel bazlı enjeksiyon: Çin’de yapılan EXIT‑SEP randomize klinik çalışmasında, bitkisel bazlı bir enjeksiyonun 28‑gün mortaliteyi azalttığı bildirildi; ancak bu sonuçlar spesifik formülasyona özgü ve genellenemez.
Toksisite riski: Bazı bitkisel metabolitler (alkaloidler, glikozidler, terpenoidler, flavonoidler) toksik etkilere sahip olabilir; bu nedenle yalnızca klinik gözetim altında kullanılmalıdır.
Klinik çalışmalarda kullanılan doz aralıkları
Kurkumin (Zerdeçal)
Klinik denemelerde genellikle 500 mg – 2 g/gün oral kapsül formunda kullanıldı.
Bazı çalışmalarda nanopartikül veya liposomal formülasyonlar biyoyararlanımı artırmak için tercih edildi.
Resveratrol
İnsan çalışmalarında 150 mg – 500 mg/gün oral doz aralıkları test edildi.
Yüksek dozlarda biyoyararlanım sınırlı; metabolizması hızlı.
Epigallokateşin gallat (EGCG, Yeşil çay)
Klinik denemelerde 200 mg – 800 mg/gün aralıkları kullanıldı.
Genellikle yeşil çay ekstraktı kapsül formunda.
Beta‑glukanlar (Mantar polisakkaritleri)
Çalışmalarda 250 mg – 1 g/gün oral veya parenteral destek olarak verildi.
Bazı kanser hastalarında immün destek amacıyla kullanıldı.
Quercetin
Klinik denemelerde 500 mg – 1000 mg/gün oral kapsül formunda.
Biyoyararlanımı düşük olduğu için liposomal veya kompleks formülasyonlar tercih edilebiliyor.
Omega‑3 yağ asitleri (EPA/DHA)
Kritik hastalarda enteral/parenteral destekle 2–4 g/gün toplam EPA+DHA kullanıldı.
Çalışmalarda inflamatuvar belirteçlerde azalma raporlandı.
Yan etki ve güvenlik profilleri
Kurkumin: Yüksek dozlarda antikoagülan etkiyi artırabilir; DIC öyküsü olan hastalarda dikkatli olunmalı.
Resveratrol: Benzer şekilde kanama riskini artırabilir; trombosit fonksiyonunu etkileyebilir.
EGCG: Yüksek dozlarda hepatotoksisite riski bildirilmiş; karaciğer fonksiyonları izlenmeli.
Beta‑glukanlar: Genellikle güvenli; ancak immün sistemi aşırı aktive etme riski teorik olarak var.
Quercetin: Yüksek dozlarda böbrek fonksiyonları üzerine olumsuz etkiler raporlanmış.
Omega‑3: Yüksek dozlarda kanama süresini uzatabilir; antikoagülan tedavi alanlarda dikkatli olunmalı.
Akademik bağlamda özet
Sepsis ve DIC gibi yüksek mortalite riski taşıyan durumlarda kurkumin, resveratrol, EGCG, beta‑glukan, quercetin ve omega‑3 gibi doğal metabolitler, klinik araştırmalarda immün modülasyon ve inflamasyon kontrolünde tamamlayıcı destek olarak incelenmiştir. Ancak bu ajanlar konvansiyonel tedavinin yerine geçmez; yalnızca doktor gözetiminde, bireysel riskler (kanama, ilaç etkileşimi, toksisite) dikkate alınarak kullanılabilir.
Bu bileşenler klinik çalışmalarda tamamlayıcı destek olarak incelenmiştir. Doz aralıkları genellikle 500 mg – 2 g/gün bandında değişir (omega‑3 için gram düzeyinde). Güvenlik profilleri çoğunlukla iyi, ancak kanama riski, hepatotoksisite ve ilaç etkileşimleri kritik hastalarda göz önünde bulundurulmalıdır.
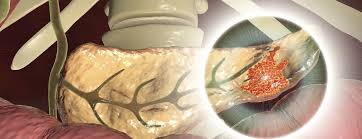
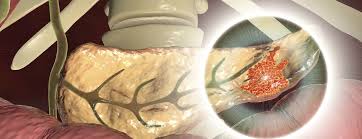
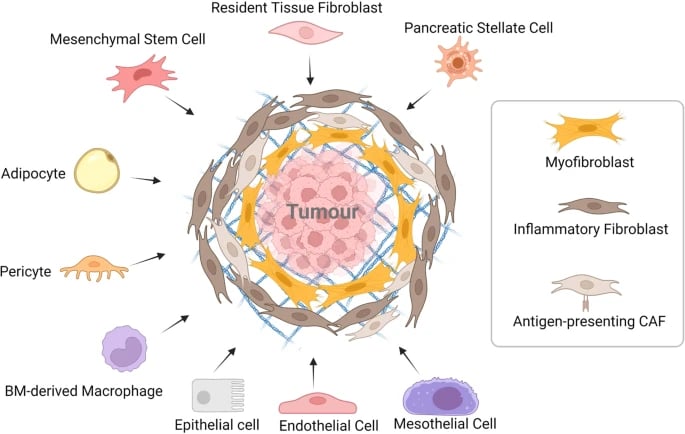
Pankreas kanserinde (PDAC) kanserle ilişkili fibroblastlar (CAF'ler) çeşitli hücrelerden kaynaklanır. PSC'ler ve diğer yerleşik doku fibroblastları, kanserle ilişkili fibroblastlara dönüştürülebilir. Tümör mikroortamındaki sitokinler ve kemokinler, MSC'lerin, perisitlerin ve adipositlerin CAF'lere farklılaşmasına ve tümöre çekilmesine neden olabilir. Kemik iliğinden türetilen makrofajların bir alt kümesi, CAF benzeri hücrelere dönüşerek pankreas kanseri ilerlemesini destekler. Transdiferansiyasyon, epitel, endotel ve mezotel hücrelerinin CAF popülasyonuna katılmasını sağlar. myCAF, iCAF ve apCAF, PDAC'de keşfedilen farklı CAF fenotipleridir. myCAF, tümöre yakın bir konumda bulunurken, iCAF tümörden daha uzaktadır; apCAF ise tümör mikroortamında immün baskılamayı destekleyen daha küçük bir alt kümedir.


CAF'ler, ECM bileşenlerini salgılar ve fibrotik tümör mikroortamına katkıda bulunur. SHH, TGF-β, IL-1, PDGF ve HIF-1 gibi kanser hücresi kaynaklı sitokinler, CAF aktivasyonunda önemlidir ve aktive olmuş CAF'ler, tümör oluşumunu destekleyici faktörler salgılayarak kanser hücresi proliferasyonunu teşvik eder. Ayrıca, PDAC hücreleri tarafından salınan eksozomlar, CAF'lerin toplanmasına ve aktivasyonuna yardımcı olabilir. Pankreatik CAF'ler, IL-6, CXCL2, CXCL12 ve CXCL8 gibi faktörler salgılayarak inhibitör immün mikroortamın oluşumuna katkıda bulunur. CAF'ler sadece immün baskılayıcı hücrelerin toplanmasından ve düzenlenmesinden sorumlu olmakla kalmaz, aynı zamanda immün kontrol noktası belirteçlerini artırarak CD8+ T hücrelerinin anti-tümör fonksiyonlarını yerine getirmesini de engeller.
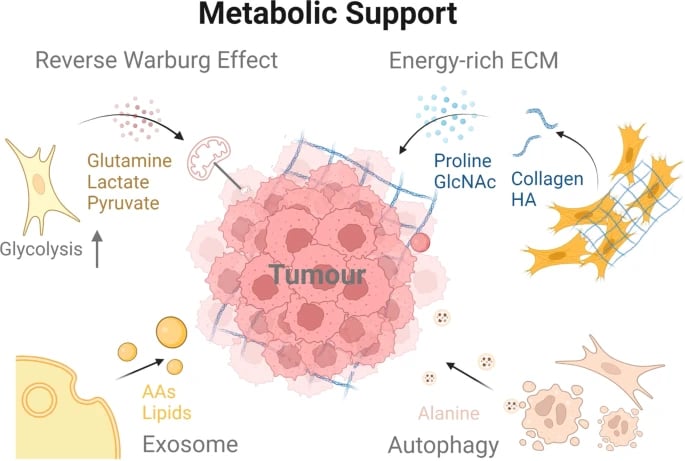
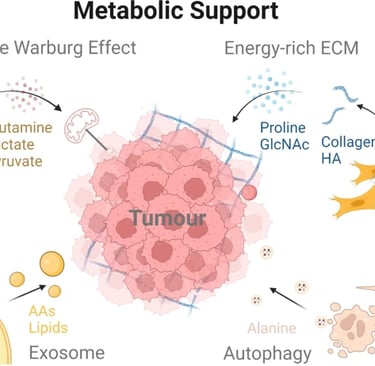
CAF'ler, kötü huylu hücrelerin besin eksikliğinin üstesinden gelmesine yardımcı olur. Tümör hücrelerinin etkisi altında, CAF'ler aerobik glikoliz gerçekleştirir ve pankreas adenokarsinomu (PDAC) hücrelerine besin sağlar. Dahası, CAF'lerden türetilen kolajenler ve hücre dışı matristeki hyaluronik asit (HA) de tümör hücreleri tarafından kullanılabilir. Ayrıca, CAF'ler kötü huylu hücrelerin metabolizmasının yeniden programlanmasına katkıda bulunur. CAF'ler tarafından salınan eksozomlar da PDAC hücrelerindeki metabolizmayı besleyebilir. Dahası, CAF'ler ottofajiye katılarak mitokondriyal metabolizma ve tümör büyümesi için alternatif karbon kaynakları olarak hizmet eden enerji açısından zengin metabolitler üretir.
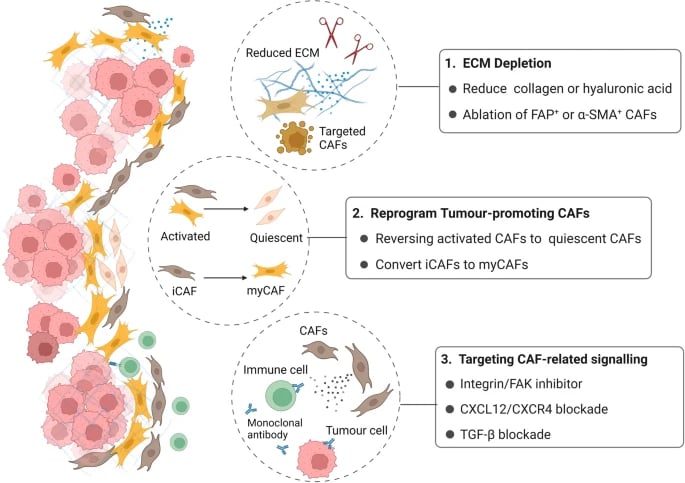
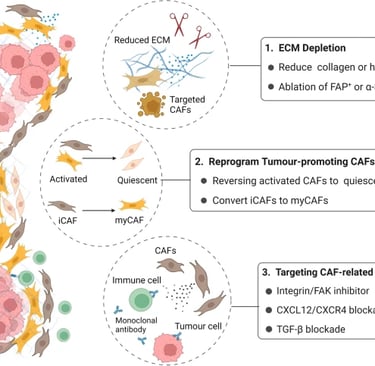
(1) ECM ve CAF tükenmesi. PDAC fibrozunun temel bileşenleri olan kolajen ve hyaluronik asidi parçalayın veya PDAC desmoplazisini önlemek için belirli CAF alt popülasyonlarını tek başına yok edin.
(2) Tümör mikroortamını iyileştirmek için tümör gelişimini destekleyen CAF'ları devre dışı bırakın veya normal fibroblastlara yeniden programlayın. Bazı çalışmalarda, tümör ilerlemesini engellemek için iCAF'lar myCAF'lara dönüştürülür.
(3) CAF'lar, tümör hücreleri ve bağışıklık hücreleri arasındaki çapraz etkileşimde yer alan temel sitokinleri ve kemokinleri hedefleyin ve ilgili sinyalleşmeyi bloke edin; örneğin FAK sinyalleşmesi, CXCL12-CXCR4 ekseni ve TGF-β sinyalleşmesi.


Obez bireylerde pankreas kanseri ortamı. Yağ dokusu ve iltihabı, karsinogenezde ve tümör mikroortamında merkezi bir rol oynar. Yağ dokusu tarafından salgılanan adipokinler, sitokinler, kemokinler ve diğer inflamatuar medyatörler pankreası etkiler. Yağ dokusu iltihabı ayrıca insülin direncine de neden olur. Yüksek insülin seviyelerinin PDAC hücre büyümesine ve metabolik dislipidemiye neden olduğu bilinmektedir. Lipid metabolizmasının düzensizliği de kanser hücrelerinde önemli bir rol oynar. Özellikle, (i) kolesterolün hücre dışı alımının artması, (ii) yağ asidi sentezinin artması, (iii) doymamış ve doymuş yağ asitleri arasındaki dengesizlik ve (iv) anormal FABP ekspresyonları PDAC hücrelerinde önemli metabolik değişikliklerdir.
İletişim
Bize ulaşmak için aşağıdaki bilgileri kullanın.
Hİzmetler
Tıbbi Sorumluluk Reddi (Disclaimer):
Bu web sitesinde sunulan tüm içerikler yalnızca bilgilendirme amacı taşır. Sunulan bilgiler, profesyonel tıbbi tanı, tedavi ya da tavsiye yerine geçmez. Web sitesinde yer alan sağlık bilgilerinin, tıbbi karar verme sürecinizde tek başına kullanılmaması gerekir. Herhangi bir sağlık sorununuzda, şikâyetinizde ya da tedavi ihtiyacınızda mutlaka bir doktor veya ilgili uzman sağlık profesyoneline danışınız. Bu sitede yer alan bilgilerin kullanımından doğabilecek herhangi bir doğrudan ya da dolaylı zarardan dolayı site sahibi veya yazarlar sorumluluk kabul etmez.
© 2025 İlkiz Açıkalın
