"Bitkisel Kozmetik"
TELOMERAZ: HÜCRESEL ZAMANIN MÜHRÜ VE YAŞAM SÜRESİNİN KONTROLÜ
Dr. Aleksi
11/29/20256 min oku
TELOMERAZ: HÜCRESEL ZAMANIN MÜHRÜ VE YAŞAM SÜRESİNİN KONTROLÜ
TELOMERLER VE HAYATIN GERİ SAYIMI
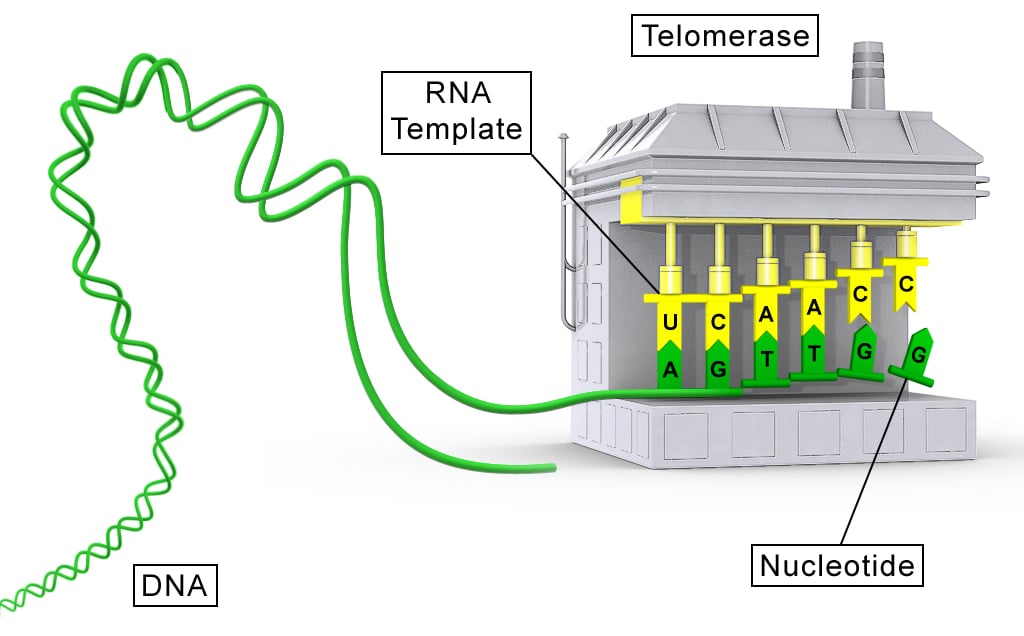
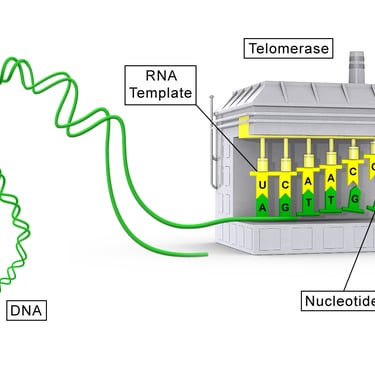
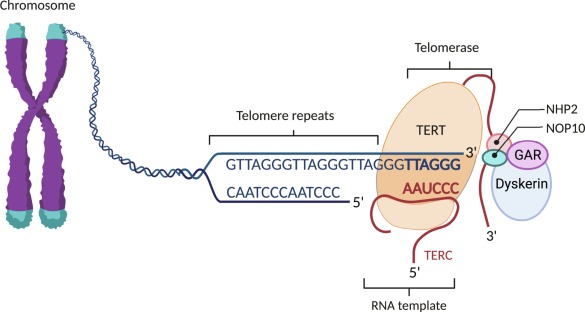
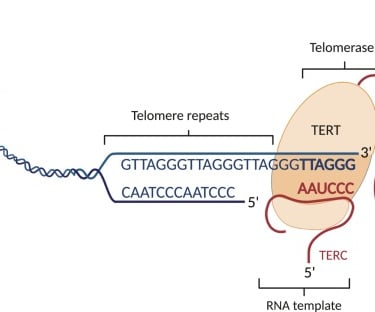
İnsan genomu, DNA'nın kromozomlara sıkıştırılmasıyla düzenlenir. Her kromozomun ucu, tekrar eden nükleotid dizilerinden (TTAGGG) oluşan ve onu bütünlüğünü korumaya yarayan Telomerler ile kaplıdır.
Hücresel Yaşlanma: Hücre her bölündüğünde telomerler kısalır (her seferinde yaklaşık 50 ila 200 baz çifti); bu süreç hücresel bir “geri sayım saati” gibi işler. Telomerler kritik bir uzunluğun altına indiğinde hücreler bölünmeyi durdurur ve 'Senesens' (Yaşlanma) sürecine girer. Kısa telomerler; diyabet, kardiyovasküler hastalık ve organ gerilemesi dahil olmak üzere birçok patolojiyle ilişkilendirilmiştir.
1. TELOMERAZIN KEŞFİ VE EVRİMSEL ROLÜ
Telomeraz, kromozomların kısalan uçlarına DNA ekleyerek hücrenin ömrünü uzatan bir enzimdir ve bu nedenle "ölümsüzlük enzimi" olarak anılır (Keşif, 2009 Nobel Tıp Ödülü ile taçlandırılmıştır).
A. Biyolojik Kontrol ve Evrimsel Denge
Telomeraz geni hepimizde bulunsa da, aktivitesi çoğu yetişkin hücrede susturulmuştur; yalnızca üreme hücrelerinde, embriyo hücrelerinde ve kök hücrelerde çalışır. Evrimsel açıdan bu sınırlı aktivite, iki önemli dengeyi yansıtır:
Uzun Ömür vs. Kanser Riski: Telomerazın sürekli aktif olması, hücrelerin ölümsüzleşmesine yol açarak kanser riskini artırır. Telomerler aynı zamanda genomik hasarın moleküler sensörleri olarak görev yapar ve hasarlı hücrelerin çoğalmasını sınırlarlar.
Kanser Paradoksu: Kötü huylu tümörlerin %90'ı, telomerazı yeniden aktive ederek sınırsız bölünme yeteneği kazanır. Bu durum, telomerazın somatik hücrelerde baskılanmasının, kanserden korunma açısından evrimsel bir avantaj olduğunu gösterir.
B. Telomer Uzunluğu ve Bağışıklık Sistemi
Telomer uzunluğu, bağışıklık hücrelerinin işleviyle doğrudan ilişkilidir. T lenfositleri telomerlerini koruyarak uzun süre aktif kalabilirken, yaşlanmayla birlikte telomer kısalması, bağışıklık sisteminin “yaşlanmasına” (İmmünosenesans) yol açar ve enfeksiyonlara karşı savunmayı azaltır. Telomerazın kontrollü aktivasyonu, bağışıklık hücrelerinin ömrünü uzatarak yaşlı bireylerde bağışıklık fonksiyonunu güçlendirme potansiyeline sahiptir.
2. YAPISAL KEŞİF VE TERT'İN KANONİK OLMAYAN İŞLEVLERİ
A. Yapının Çözülmesi ve İlaç Hedefleme
UC Berkeley’deki bilim insanları, Kriyo-elektron mikroskobu kullanarak telomerazın bugüne kadarki en ayrıntılı yapısını (7-8 Ångström çözünürlük) elde etti. Bu buluş, enzimin 11 alt birimden oluştuğunu netleştirerek (akıllı) ilaç tasarımında kritik bir dönüm noktası oldu.
Tanısal Önemi: Yeni yapı, telomerazdaki mutasyonların neden enzimin işlevini bozduğunu ve aplastik anemi, pulmoner fibrozis gibi hastalıklara yol açtığını anlamayı kolaylaştırmaktadır.
İlaç Geliştirme: Telomerazın detaylı yapısının bilinmesi, hangi bölgelerin potansiyel ilaç hedefi olabileceğini belirlemede bir rehberdir.
B. TERT (Telomerase Reverse Transcriptase) ’in Mitokondriyal ve Nöroprotektif Rolü
Telomerazın katalitik alt birimi olan TERT, telomer uzatmanın ötesinde hücre içinde farklı roller üstlenir:
Mitokondriyal İşlev: TERT, stres koşullarında mitokondrilere taşınabilir. Burada DNA'yı oksidatif hasardan korur ve reaktif oksijen türlerinin (ROS) üretimini azaltarak mitokondriyal fonksiyonları destekler. Bu işlev, özellikle yüksek enerji tüketen hücrelerde (nöronlarda) kritiktir.
Nöroproteksiyon: Nörodejeneratif hastalıklarda (Alzheimer, Parkinson), TERT’in mitokondriyal işlevleri ve oksidatif stresi azaltma potansiyeli, nöron kaybını yavaşlatarak nöroprotektif etki gösterebilir. Bölünmeyen nöronlarda TERT'in telomer-dışı bu işlevleri, nöron sağlığı için kritik olabilir.
3. KLİNİK YANSIMALAR VE TERT İNHİBİTÖRLERİ
Telomerazı hedefleyen yaklaşımlar, kanser ve yaşlanma alanlarında ikili bir tedavi stratejisine rehberlik eder.
A. Klinik Telomeraz İnhibitörleri (Kanser Tedavisi)
Telomerazı bloke etmek, tümörlerin bölünme yeteneğini durdurmayı amaçlar.
Antisense Oligonükleotidler: En bilinen örnek Imetelstat (GRN163 L)’dir. TERC'yi hedefleyerek aktiviteyi durdurur ve hematolojik kanserlerde yanıtlar bildirilmiştir. Ancak sitopeni ve karaciğer toksisitesi gibi yan etkiler kısıtlayıcıdır.
Diğer Stratejiler: BIBR1532 gibi küçük molekül inhibitörleri ve hTERT peptid aşıları gibi immünoterapiler, tümörlerdeki TERT ekspresyonunu hedeflemeyi amaçlar.
B. Terapötik Zorluklar ve Güvenlik
Telomeraz aktivitesini gelişigüzel değiştirmek hayati tuzaklar içerir. Kontrolsüz aktivasyon kanser riskini artırır; inhibitörler ise kemik iliği toksisitesi ve tümörün alternatif uzatma mekanizmalarına (ALT) direnç geliştirmesi gibi zorluklarla karşılaşır.
Gelecek Vizyonu: Klinik çalışmalar, telomerazı sadece belirli hücrelerde, dokuya özgü ve kontrollü sürelerde değiştirmeyi hedeflemelidir. Bu, telomeraz aktivatörlerinin, nöroprotektif etki göstermesi veya kök hücrelerin ömrünü uzatması için kanserleşme riski olmadan güvenli hale getirilmesinin tek yoludur.
Telomeraz Kontrolü ve Biyolojik Korunum: Doğal mekanizmalar:
Telomerazı aktive etmek, teorik olarak biyolojik süreyi uzatsa da, bu durum $\text{DNA}$ hasarı olan hücrelerde kanser riskini kaçınılmaz olarak artırır. Bu nedenle, aranan ideal bileşenler, telomerazı doğrudan ve güçlü bir şekilde aktive etmekten ziyade, telomer uzunluğunu koruyan veya dolaylı yoldan aktive eden ve aynı zamanda hücresel sağlığı destekleyen güvenlik mekanizmalarını (örneğin $\text{DNA}$ onarımı ve Otofaji) güçlendiren bileşenlerdir.
1. Telomeraz Aktivasyonu ve Telomer Uzaması
Telomeraz aktivitesini artırdığı gösterilen veya telomer kısalmasını yavaşlatan bazı doğal bileşenler bulunmaktadır:
Sikloastragenol (Astragalus membranaceus Türevi):
Etkisi: Bu molekül, ticari olarak TA-65 adı altında mevcuttur. Çalışmalar, TERT (Telomerazın katalitik alt birimi) aktivitesini doğrudan ve güçlü bir şekilde artırabildiğini göstermiştir. Bu, telomerleri uzatarak hücrelerin bölünme kapasitesini artırır.
Kıyaslama: Telomeraz aktivasyonunda en güçlü ve en çok çalışılan doğal bileşendir. Ancak, doğrudan aktivasyon potansiyeli nedeniyle, klinik olarak $\text{DNA}$ hasarı olmayan bireylerde bile kontrollü kullanılması gerekir.
Oleanolic Asit (Zeytin Yaprağı ve Diğer Bitkiler):
Etkisi: Bazı çalışmalarda telomeraz aktivitesini artırıcı etki göstermiştir. Bu, hücresel korunumda rol oynayan daha genel NF-kappaB gibi yolları modüle etmesiyle ilişkili olabilir.
Omega-3 Yağ Asitleri (EPA ve DHA):
Etkisi: Omega-3'ler doğrudan telomerazı aktive etmez, ancak oksidatif stresi ve sistemik inflamasyonu azaltarak telomerlerin kısalma hızını yavaşlattığı gözlemlenmiştir.
Kıyaslama: Telomer uzunluğunu dolaylı yoldan koruyan (koruyucu mekanizma) bir ajandır, doğrudan aktive eden değildir. Kanser riskini artırmadan telomer bütünlüğünü desteklemede daha güvenlidir.
2. Otofaji Teşvik Edici Bitkiler:
Otofaji (Hücresel temizlik), yaşlanmış ve hasarlı moleküler yapıları yıkarak hücresel düzeni (Negatif Entropi) korur. Bu süreç, telomerazın neden olduğu hasarlı hücrelerin ölümsüzleşmesi riskine karşı bir denge mekanizmasıdır.
Resveratrol:
Etkisi: Özellikle sirtuinler (SIRT1) yoluyla DNA onarımını ve hücresel düzeni desteklerken, otofajiyi güçlü bir şekilde teşvik eder.
Kıyaslama: Resveratrol, yaşlanma sürecine (Senesens) karşı hem DNA onarımı hem de Otofaji yoluyla etki eden, çift yönlü koruyucu bir ajandır. Telomerazı direkt aktive etmez, ancak hücresel çevreyi sağlıklı tutar.
Spermidin:
Etkisi: Besinlerde doğal olarak bulunur ve otofajiyi indüklemede çok etkilidir. Yaşlanmış hücre bileşenlerinin temizlenmesini hızlandırır.
Kıyaslama: Bu molekül, hücrelerin kendini yenileme kapasitesini artırarak telomeraz aktivasyonunun getireceği potansiyel tehlikeye karşı sağlıklı hücre temizliğini önceler.
Berberin:
Etkisi: AMPK yolağını aktive ederek ATP düşüşünü simüle eder, bu da hem metabolizmayı iyileştirir hem de otofajiyi teşvik eder.
Kıyaslama: Berberin, diyabet ve kardiyovasküler hastalıklarla ilişkili kısa telomerlerin getirdiği sistemik sorunları hedeflemede dolaylı rol oynar.
3. Kök Hücre Yaratıcı(Destekleyiciler:
Telomeraz, sadece kök hücrelerde aktif olduğu için, tedavinin amacı kök hücrelerin aktivitesini kontrollü olarak uzatmaktır.
Astragalus (Sikloastragenol İçeriği):
Kıyaslama: Kök hücrelerin ömrünü doğrudan telomer uzaması yoluyla uzatan en net mekanizmaya sahiptir. Bu, rejeneratif tıpta önemli potansiyel taşır.
Kurkumin (Zerdeçal):
Etkisi: Güçlü bir anti-inflamatuar ve antioksidan ajandır. Kök hücrelerin nişlerini (Stem Cell Niche) inflamasyondan koruyarak fonksiyonlarını dolaylı yoldan destekler.
Kıyaslama: Telomerazı aktive etmez, ancak kök hücrenin sağlıklı çevrede kalmasını sağlayarak uzun süreli fonksiyonunu korur.
Telomeraz aktivasyonu (Sikloastragenol) yüksek ödül (telomer uzaması) ancak yüksek risk (kanser) taşır. Buna karşılık Otofaji teşvik ediciler (Resveratrol, Spermidin) ve dolaylı koruyucular (Omega}-3), hücreleri temizleyip DNA'yı koruyarak telomer bütünlüğünü destekleyen, daha güvenli ve bütüncül yaklaşımlardır. Gelecekteki tedaviler, telomeraz aktivasyonu ile DNA onarımı/Otofaji teşvikini zaman ve doza bağlı olarak birleştiren akıllı protokoller üzerine kurulmalıdır.
SONUÇ: Telomeraz, biyolojik süreyi uzatma ile kanser riskini dengeleyen, evrimsel açıdan kritik bir mekanizmadır. Yapısal keşifler, bu çift yönlü rolün kontrollü biçimde kullanılmasına yönelik yeni ufuklar açmıştır. Gelecekteki araştırmalar, TERT'in mitokondriyal işlevleri, DNA onarımı ve bağışıklık sistemi üzerindeki etkilerini dikkate alarak, enzimin dokuya özgü ve zaman sınırlı hedeflenmesi üzerine yoğunlaşmalıdır.
İletişim
Bize ulaşmak için aşağıdaki bilgileri kullanın.
Hİzmetler
Tıbbi Sorumluluk Reddi (Disclaimer):
Bu web sitesinde sunulan tüm içerikler yalnızca bilgilendirme amacı taşır. Sunulan bilgiler, profesyonel tıbbi tanı, tedavi ya da tavsiye yerine geçmez. Web sitesinde yer alan sağlık bilgilerinin, tıbbi karar verme sürecinizde tek başına kullanılmaması gerekir. Herhangi bir sağlık sorununuzda, şikâyetinizde ya da tedavi ihtiyacınızda mutlaka bir doktor veya ilgili uzman sağlık profesyoneline danışınız. Bu sitede yer alan bilgilerin kullanımından doğabilecek herhangi bir doğrudan ya da dolaylı zarardan dolayı site sahibi veya yazarlar sorumluluk kabul etmez.
© 2025 İlkiz Açıkalın
